Historia de la química para niños
La historia de la química es un viaje fascinante que nos muestra cómo la humanidad ha ido descubriendo y entendiendo el mundo que nos rodea, desde la prehistoria hasta hoy. Está muy conectada con cómo las personas han desarrollado su cultura y su conocimiento de la naturaleza.
Las civilizaciones antiguas ya usaban técnicas que demostraban que sabían cómo se transformaban las cosas. Algunas de estas técnicas fueron la base para los primeros estudios de la química. Por ejemplo, aprendieron a sacar metales de las minas, a crear mezclas de metales como el bronce, a fabricar cerámica, esmaltes y vidrio. También sabían cómo hacer bebidas como la cerveza y el vino, cómo extraer sustancias de las plantas para medicinas o perfumes, y cómo convertir las grasas en jabón.
Al principio, ni la filosofía ni la alquimia (que fue como una química antigua) pudieron explicar bien cómo era la materia y cómo cambiaba. Sin embargo, los alquimistas, al hacer muchos experimentos y anotar sus resultados, sentaron las bases para la química moderna.
Un momento clave para la química moderna fue en 1661, con el libro de Robert Boyle llamado El químico escéptico: o las dudas y paradojas quimio-físicas. En este libro, Boyle separó claramente la química de la alquimia y propuso usar el método científico en los experimentos químicos. Se considera que la química se convirtió en una ciencia completa gracias a las investigaciones de Antoine Lavoisier y su esposa Marie-Anne Pierrette Paulze. Ellos descubrieron la ley de conservación de la materia y otros principios que son fundamentales para la química. Desde el siglo XVIII, la química se convirtió en una ciencia experimental moderna. Se crearon formas más exactas de medir, lo que ayudó a entender mejor los fenómenos y a dejar de lado ideas que no estaban probadas.
La historia de la química también se relaciona con la historia de la física, especialmente con la teoría atómica y la termodinámica.
| Época del descubrimiento de los elementos químicos | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
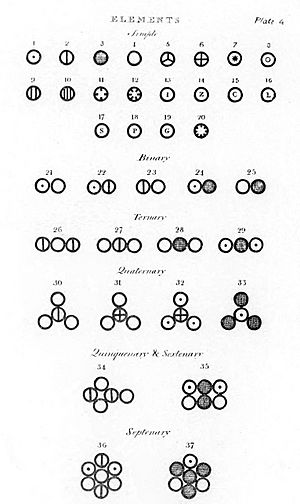
Clave de colores: Antes del 1500 (13 elementos): Antigüedad y Edad Media. 1500-1800 (+21 elementos): casi todos en el Siglo de las Luces. 1800-1849 (+24 elementos): revolución científica y revolución industrial. 1850-1899 (+26 elementos): gracias a la espectroscopia. 1900-1949 (+13 elementos): gracias a la teoría cuántica antigua y la mecánica cuántica. 1950-2000 (+17 elementos): elementos "postnucleares" (del nº at. 98 en adelante) por técnicas de bombardeo. 2001-presente (+4 elementos): por fusión nuclear.
Contenido
- Los primeros pasos de la química
- Ideas filosóficas antiguas
- La alquimia: entre el misterio y la experimentación
- Siglos XVII y XVIII: el nacimiento de la química moderna
- Siglo XIX: el regreso de la teoría atómica
- John Dalton: la teoría atómica moderna
- Jöns Jacob Berzelius: la notación química moderna
- Davy y la electrólisis
- Gay-Lussac y las leyes de los gases
- Amedeo Avogadro y el número de moléculas
- El inicio de la química orgánica y su industria
- El Congreso de Karlsruhe y la unificación de criterios
- Espectroscopía y tubos de descarga
- Kekulé y la estructura orgánica
- Mendeléyev y la tabla periódica
- Josiah Willard Gibbs y la termodinámica
- Van't Hoff y Arrhenius
- Descubrimientos de finales del siglo XIX
- Marie y Pierre Curie: la radioactividad
- Siglo XX: se revela la estructura del átomo
- Galería de imágenes
- Véase también
Los primeros pasos de la química
Desde la prehistoria, la humanidad aprendió a transformar la materia para sobrevivir y mejorar su vida. Uno de los descubrimientos más importantes fue el fuego. Hay pruebas de que los humanos controlaban el fuego hace unos 1.600.000 años, desde los tiempos del Homo erectus. Este logro fue muy importante porque el fuego daba calor y luz, protegía de animales salvajes, ayudaba a despejar bosques para cazar o cultivar, y fue la base para controlar otras reacciones químicas. Por ejemplo, cocinar alimentos (lo que los hacía más fáciles de digerir y eliminaba gérmenes) y, más tarde, tecnologías como la cerámica, la fabricación de ladrillos, la metalurgia, el vidrio o la destilación de perfumes y medicinas de plantas. Aunque el fuego fue la primera reacción química controlada, las culturas antiguas no sabían por qué ocurría. Durante miles de años, lo vieron como una fuerza misteriosa que transformaba sustancias y producía luz y calor.
Las primeras civilizaciones, como los sumerios, egipcios y babilonios, tenían mucho conocimiento práctico sobre la metalurgia, la cerámica y los tintes, pero no desarrollaron teorías complejas sobre lo que observaban.
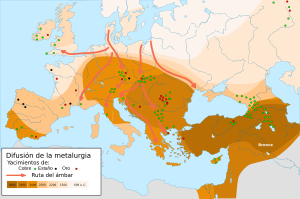
La metalurgia: el arte de los metales
El primer metal que usaron los humanos fue el oro, que se encuentra puro en la naturaleza y no necesitaba transformaciones químicas. La plata y el cobre también se encontraban puros en pequeñas cantidades, lo que permitía hacer algunos objetos. Al principio, las técnicas se limitaban a fundir los metales con fuego para purificarlos y darles forma. Pero como los metales puros eran escasos, se hizo necesario aprender a extraerlos de sus minerales, lo que sí implicaba controlar reacciones químicas.
El bronce: una aleación revolucionaria
Algunos metales, como el estaño y el plomo, se pueden obtener de sus minerales simplemente calentándolos en una hoguera. El cobre necesita temperaturas más altas, en un horno. Este proceso se llama fundición. Las primeras pruebas de extracción de metales se encontraron en Turquía (hacia el 6400 a. C.) y Serbia (entre el 5000 y 6000 a. C.).
Al principio, los metales se usaban solos o mezclados tal como se encontraban. Pero al mezclar cobre con estaño o arsénico a propósito, se obtuvieron metales con mejores cualidades, llamados bronces. Este avance tecnológico dio origen a la Edad del Bronce. La tecnología del bronce se desarrolló en el Oriente Próximo a finales del 4000 a. C. y se extendió por otras partes del mundo. La Edad del Bronce no solo fue importante por el desarrollo de la metalurgia, sino que también influyó en la agricultura y en la creación de grandes ejércitos, fomentando el comercio de minerales y productos.
El hierro: un metal más fuerte
Extraer hierro de sus minerales es mucho más difícil que el cobre y el estaño, ya que requiere un proceso de fundición más complejo con carbón y temperaturas más altas. A cambio, se obtiene un metal más duro y resistente que el bronce, y mucho más abundante. Las técnicas para fundir hierro pudieron haberse desarrollado en diferentes lugares del mundo al mismo tiempo. Hay restos de herramientas de hierro en Turquía (hacia el 1800 a. C.), en la India (entre el 1800 y 1200 a. C.) y en África (hacia el 1200 a. C.).
La mayoría de los métodos antiguos para extraer y purificar metales se describen en la obra de Plinio el Viejo, Naturalis Historia.

La cerámica y el vidrio
El uso del fuego también dio origen a otras dos tecnologías importantes: la cerámica y el vidrio. La cerámica se originó en el Neolítico, cuando los humanos descubrieron que los recipientes de arcilla se volvían más resistentes al agua si se calentaban. Para controlar mejor este proceso, se crearon diferentes tipos de hornos.
En Egipto, se descubrió que al cubrir la cerámica con mezclas de ciertos minerales, se formaba una capa dura, menos porosa y brillante, llamada esmalte. Su color podía cambiarse añadiendo otros minerales o variando las condiciones del horno. En China, se perfeccionaron las técnicas de cerámica hasta crear la porcelana en el siglo VII.
El vidrio se desarrolló a partir del cuarzo y el carbonato de sodio o carbonato de potasio. Su desarrollo comenzó en el Antiguo Egipto y fue perfeccionado por los romanos. La producción masiva de vidrio a finales del siglo XVIII llevó a buscar nuevos métodos para obtener carbonato de sodio, lo que impulsó enormemente la industria química.
Transformaciones orgánicas antiguas
Las sociedades antiguas usaban algunas transformaciones químicas naturales, como las fermentaciones del vino, la cerveza o la leche. También sabían cómo el alcohol se convertía en vinagre, que usaban para conservar alimentos. Las pieles se curaban sumergiéndolas en orina vieja o soluciones de palomina. Además, conocían el proceso de fabricación de jabón, con registros que datan de Babilonia alrededor del 2800 a. C.
Ideas filosóficas antiguas
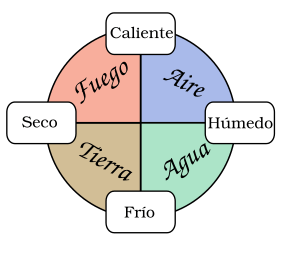
Los filósofos antiguos intentaron entender por qué las sustancias tenían diferentes propiedades (color, dureza, olor), estados (líquido o sólido) y reaccionaban de distintas maneras. Esto los llevó a crear las primeras teorías sobre la química y la naturaleza de la materia. Un punto común en todas estas teorías era la búsqueda de unos pocos elementos primarios que se combinarían para formar todas las demás sustancias. Solían ser sustancias conocidas como el agua, la tierra, la madera o el aire, y formas de energía como el fuego o la luz.
En la Grecia Clásica, alrededor del 450 a. C., Empédocles dijo que toda la materia estaba hecha de cuatro elementos: tierra, fuego, aire y agua. Más tarde, Aristóteles añadió el éter, una sustancia celestial e inmutable, ya que no veía cambios en las estrellas y planetas. Las ideas de Aristóteles sobre la composición y transformación de la materia dominaron el pensamiento occidental y de Oriente Medio durante dos milenios.
Los primeros atomistas

Las primeras ideas sobre el atomismo surgieron en la Antigua Grecia y la Antigua India. En Grecia, Leucipo de Mileto y su alumno Demócrito (hacia el 380 a. C.) propusieron que la materia estaba compuesta por partículas diminutas, indivisibles e indestructibles, a las que llamaron átomos (del griego «sin partes»). Ideas similares fueron planteadas por el filósofo indio Kanada.
Sin embargo, estas teorías antiguas no tenían pruebas experimentales. En Occidente, el atomismo no fue la idea principal. Aristóteles se opuso a la existencia de los átomos en el 330 a. C., y su influencia hizo que estas ideas se dejaran de lado durante siglos, hasta la Edad Moderna.
La alquimia: entre el misterio y la experimentación
La alquimia fue una práctica antigua que mezclaba elementos de la química, la metalurgia, la física y la medicina con la astrología y el misticismo. Se practicó en muchas civilizaciones, desde Mesopotamia hasta Europa, durante al menos 2500 años.
La búsqueda de la piedra filosofal
La alquimia se conoce por la búsqueda de la piedra filosofal, una sustancia legendaria que supuestamente podía convertir metales en oro o dar la inmortalidad. Los alquimistas buscaban transformaciones tanto espirituales como prácticas. Los aspectos prácticos de la alquimia contribuyeron al desarrollo de la química. Antes del siglo XVIII, no había mucha diferencia entre alquimia y química.
Una de las principales contribuciones de la alquimia fue el desarrollo de muchos instrumentos de laboratorio. Los primeros alquimistas occidentales inventaron equipos y procesos que la química usaría después. Por ejemplo, el baño maría lleva el nombre de María la Judía, considerada una de las fundadoras de la alquimia.
En su búsqueda de la piedra filosofal, los alquimistas descubrieron y aprendieron a purificar muchas sustancias químicas como el alcohol, el amoníaco, la sosa cáustica, el vitriolo, el ácido clorhídrico, el ácido nítrico, el ácido cítrico, el ácido acético, el ácido fórmico, el arsénico, el antimonio, el bismuto y el fósforo, entre otras.
Elementos y metales en la alquimia
El sistema de elementos que usó la alquimia medieval fue desarrollado por el alquimista persa Jābir ibn Hayyān. Se basaba en los cuatro elementos griegos (aire, tierra, fuego y agua) y añadía dos elementos filosóficos: el azufre (que representaba la capacidad de arder) y el mercurio (que representaba las propiedades metálicas).
En la Edad Media en Occidente, se relacionaba la alquimia con la astrología. Se conocían siete metales y siete astros, y se asociaba cada metal con un astro. Por ejemplo:
- Sol — oro
- Luna — plata
- Mercurio — mercurio
- Venus — cobre
- Marte — hierro
- Júpiter — estaño
- Saturno — plomo

La alquimia en el mundo islámico
En el mundo islámico, la alquimia continuó desarrollándose, traduciendo obras griegas y egipcias. El desarrollo del método científico moderno comenzó con alquimistas musulmanes medievales, como el persa Jābir ibn Hayyān (siglo IX), considerado uno de los padres de la química. Él introdujo un enfoque sistemático y experimental en el laboratorio. También inventó el alambique, descubrió y analizó muchas sustancias, y distinguió entre ácidos y álcalis.
Otros sabios musulmanes como Abū al-Rayhān al-Bīrūnī, Avicena y al-Kindi criticaron las teorías de la alquimia, especialmente la transmutación de metales. Al-Razi fue el primero en rechazar la teoría aristotélica de los cuatro elementos y usó el laboratorio de una manera más moderna, diseñando más de veinte instrumentos, algunos de los cuales todavía se usan.
Problemas de la alquimia
Desde el punto de vista actual, la alquimia tenía varios problemas. Su objetivo no era aumentar el conocimiento de forma racional, sino encontrar sustancias míticas como la piedra filosofal. Los descubrimientos experimentales eran accidentales. Además, no tenía un sistema para nombrar los nuevos compuestos, y su lenguaje era muy vago y difícil de entender.
La alquimia tampoco tenía un método científico claro para que los experimentos pudieran repetirse. Muchos alquimistas incluían información irrelevante en sus notas, como los niveles de la marea o las fases de la Luna. La naturaleza secreta y el vocabulario codificado de la alquimia servían para ocultar que en realidad no tenían muchas certezas.
A pesar de las críticas y las leyes que la prohibían, la alquimia no desapareció. Algunas personas poderosas seguían creyendo que se podía descubrir la piedra filosofal. Durante el Renacimiento, la alquimia práctica siguió siendo popular, y la alquimia espiritual también floreció. Así, la búsqueda de la piedra filosofal continuó hasta principios del siglo XVIII. Algunos alquimistas de esa época, como Jan Baptist van Helmont, Robert Boyle e Isaac Newton, son reconocidos hoy por sus grandes contribuciones a la ciencia.
Siglos XVII y XVIII: el nacimiento de la química moderna
Los intentos de mejorar la extracción y el refinado de metales fueron una fuente importante de información para los químicos del siglo XVI. Destaca Georgius Agrícola (1494-1555), quien publicó De re metallica en 1556. Esta obra describe los complejos procesos de minería y metalurgia de la época, eliminando el misticismo y creando una base práctica.
En 1605, Francis Bacon publicó una obra que describía cómo debía ser la práctica experimental, lo que más tarde se conocería como el método científico. En 1615, Jean Beguin publicó el primer libro de texto de química, Tyrocinium Chymicum, donde apareció la primera ecuación química.
La obra de Jan Baptist van Helmont, Ortus medicinae (1648), se considera clave en la transición de la alquimia a la química. Contiene muchos experimentos y una versión temprana de la ley de conservación de la masa. Van Helmont también acuñó la palabra "gas" para referirse a materias "insustanciales" además del aire.
En 1669, el alquimista alemán Hennig Brandt descubrió el fósforo a partir de la orina, un material blanco que brillaba en la oscuridad.
Robert Boyle: el primer químico moderno

Se considera que el químico inglés Robert Boyle (1627-1691) separó definitivamente la química de la alquimia al mejorar el método experimental. Boyle es reconocido como el primer químico moderno y uno de los pioneros del método científico experimental. Es famoso por la ley de Boyle (1662), que describe la relación entre la presión y el volumen de un gas a temperatura constante.
La publicación de su obra El químico escéptico en 1661 es un hito. En ella, Boyle propone que todos los fenómenos son resultado de la colisión de partículas en movimiento. Defendió que la química debía ser una ciencia por sí misma y no estar subordinada a la medicina o la alquimia. Su obra contiene ideas modernas sobre átomos, moléculas y reacciones químicas, marcando el inicio de la química moderna.
Boyle también purificó sustancias químicas para obtener reacciones que pudieran repetirse. Creía que todas las teorías debían probarse experimentalmente. Realizó muchas investigaciones con una bomba de aire, observando que al sacar el aire, las llamas se apagaban y los animales morían.
La teoría del flogisto

A finales del siglo XVII y principios del siglo XVIII, se propuso la teoría del flogisto para explicar la combustión y las reacciones de óxido-reducción. Esta teoría, desarrollada por Georg Stahl, decía que toda sustancia que podía arder contenía un fluido llamado flogisto, y que la combustión era la pérdida de este flogisto.
Joseph Priestley usó esta teoría en sus experimentos con gases. Cuando calentó la cal roja de mercurio y recogió un tipo de aire que mantenía la combustión por más tiempo, lo llamó «aire desflogistizado». Más tarde, Antoine Lavoisier lo llamaría oxígeno.
La teoría del flogisto fue popular hasta que Antoine Lavoisier la refutó en 1777. Lavoisier demostró que al quemar metales, el peso del residuo (los óxidos) era mayor que el metal inicial. Esto significaba que el flogisto tendría un peso negativo, lo cual era absurdo y demostraba que la teoría no era consistente.
Descubrimientos del siglo XVIII
En el siglo XVIII, se descubrieron muchos elementos nuevos gracias a los nuevos métodos de investigación. Por ejemplo, Georg Brandt descubrió el cobalto (hacia 1735), Antonio de Ulloa el platino (1748), Axel Fredrik Cronstedt el níquel (1751), Henry Cavendish el hidrógeno (1766), y Carl Wilhelm Scheele y Joseph Priestley el oxígeno (1773-1774). Los hermanos españoles Juan José y Fausto Elhuyar aislaron el wolframio en 1783.
También se descubrieron compuestos importantes. Joseph Black aisló el dióxido de carbono en 1754 y formuló el concepto de calor latente en 1758.
Antoine Lavoisier: el padre de la química moderna

Antoine Lavoisier, un químico francés, es conocido como el «padre de la química moderna». En 1789, estableció formalmente la ley de conservación de la materia, que dice que la materia no se crea ni se destruye, solo se transforma. Lo demostró con experimentos muy precisos.
Repitiendo los experimentos de Priestley, Lavoisier demostró que el aire no era un elemento, sino que estaba compuesto por dos partes. Una de ellas se combinaba con los metales para formar óxidos. A esta parte la llamó oxígeno (que significa "formador de ácidos") y a la otra azote (sin vida). También descubrió que el hidrógeno (que significa "formador de agua") al combinarse con oxígeno producía agua, lo que demostraba que el agua tampoco era un elemento.
Lavoisier, junto con Claude Louis Berthollet y otros, creó un sistema de nomenclatura química que es la base del sistema actual para nombrar compuestos. Su libro Traité Élémentaire de Chimie (1789) fue el primer libro de texto de química moderna. En él, presentaba las nuevas teorías químicas, la ley de conservación de la masa y negaba la existencia del flogisto. También incluyó una lista de elementos que no podían descomponerse.
Lavoisier demostró que los seres vivos transformaban el aire de la misma manera que una llama. Junto a Pierre-Simon Laplace, usó un calorímetro para medir el calor producido en la combustión, tanto en llamas como en animales, lo que indicaba que los animales producían energía de forma similar a la combustión.
La contribución de Lavoisier fue fundamental para la ciencia química. Su trabajo impulsó la investigación basada en la ley de conservación de la masa, su teoría sobre la combustión con oxígeno y la teoría corpuscular mecánica, lo que se conoce como la revolución química. Después de su obra, la química se volvió una ciencia cuantitativa, capaz de hacer predicciones fiables. Lamentablemente, Lavoisier fue ejecutado durante la Revolución francesa. Después de su muerte, su esposa Marie-Anne Pierrette Paulze recopiló y publicó sus trabajos en 1803.

Volta y su pila
El físico italiano Alessandro Volta fue un pionero en el estudio de la electricidad. En 1775, perfeccionó el electróforo, un dispositivo que producía electricidad estática. En 1794, Volta investigó los estudios sobre la "electricidad animal" de Luigi Galvani, quien había observado que al juntar dos metales diferentes con el músculo de una rana, se generaba corriente eléctrica. Volta experimentó solo con metales y concluyó que el tejido animal no era necesario.
En 1800, Volta demostró el funcionamiento de la primera pila eléctrica. Su pila voltaica consistía en discos de cobre y zinc alternados, separados por tela empapada en agua salada. Al conectar los extremos, producía electricidad. Por esto, Volta es considerado el fundador de la electroquímica. Además, entre 1776 y 1778, Volta descubrió el metano.
Siglo XIX: el regreso de la teoría atómica
Después de haber sido olvidada durante siglos, la teoría atómica fue retomada por John Dalton, quien propuso que los átomos eran partículas indivisibles que no cambiaban en los compuestos. Esto permitió establecer las leyes estequiométricas, que son la base de la estequiometría actual.
A lo largo del siglo XIX, la química estuvo dividida entre quienes apoyaban y quienes rechazaban la teoría atómica de Dalton. La existencia de los átomos se confirmó definitivamente con la explicación del efecto browniano por Albert Einstein en 1905 y los experimentos de Jean Perrin.
John Dalton: la teoría atómica moderna

En 1803, el científico inglés John Dalton propuso la ley de Dalton, que relaciona las presiones de los gases en una mezcla con la presión total.
Pero su principal contribución fue una nueva teoría atómica en 1803. En 1808, Dalton publicó A New System of Chemical Philosophy, donde describía la primera teoría atómica moderna. Sus ideas principales eran:
- La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
- Los átomos de un mismo elemento son iguales entre sí y tienen la misma masa y propiedades. Los átomos de diferentes elementos tienen masas y propiedades diferentes.
- Los átomos no se dividen, incluso cuando se combinan en las reacciones químicas.
- Los compuestos químicos se forman cuando se unen átomos de dos o más elementos distintos.
- Los átomos, al combinarse para formar compuestos, lo hacen en proporciones sencillas.
- Los átomos de elementos diferentes pueden combinarse en distintas proporciones para formar más de un compuesto.
Aunque fue muy útil, la teoría atómica de Dalton tenía algunas imprecisiones y no explicaba la estructura del átomo ni por qué los elementos se unían.
Dalton también dedujo las proporciones de algunos elementos en sus compuestos, usando el peso atómico relativo. Propuso la Ley de las proporciones múltiples, que dice que cuando los elementos se combinan para formar más de un compuesto, lo hacen en proporciones fijas y enteras. Esta ley es fundamental para la estequiometría.
Por otro lado, el químico francés Joseph Proust propuso la Ley de proporciones definidas, que afirma que los elementos siempre se combinan en proporciones de números enteros y sencillos para formar un compuesto. Estas dos leyes son la base de la estequiometría.
Jöns Jacob Berzelius: la notación química moderna
Jöns Jacob Berzelius, un químico sueco, realizó mediciones precisas de sustancias químicas. En 1828, recopiló una tabla de pesos atómicos relativos, lo que apoyó la teoría atómica de Dalton. Determinó la composición exacta de muchas sustancias, confirmando la ley de proporciones definidas de Proust.
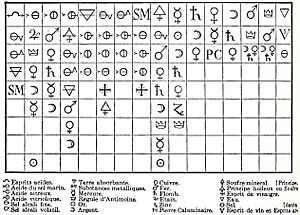
Para simplificar sus experimentos, Berzelius introdujo el sistema de símbolos químicos y notación que usamos hoy. Los nombres de los elementos se abrevian con una o dos letras de sus iniciales en latín, y las proporciones se indican con números.
A Berzelius se le atribuye el descubrimiento de los elementos silicio, selenio, torio y cerio. Sus alumnos también identificaron el litio y redescubrieron el vanadio. Berzelius también creó términos químicos como "catálisis", "polímero", "isómero" y "alótropo", aunque sus definiciones originales eran diferentes a las actuales. Por todo esto, Berzelius es considerado uno de los padres de la química moderna.
Davy y la electrólisis

El químico inglés Humphry Davy fue pionero en la electrólisis, que usa electricidad para separar compuestos. Descompuso sales fundidas y descubrió el sodio y el potasio. El potasio fue el primer metal aislado por electrólisis. En 1808, también aisló el calcio, magnesio, estroncio y bario.
Davy también experimentó inhalando gases, lo que lo llevó a descubrir los efectos del óxido nitroso, conocido como gas de la risa. En 1810, Davy le dio al cloro su nombre actual (del griego "verde amarillento") e insistió en que era un elemento, refutando la idea de Lavoisier de que todos los ácidos contenían oxígeno.
El yodo fue descubierto por el químico francés Bernard Courtois en 1811. Davy y Joseph Louis Gay-Lussac discutieron sobre quién lo identificó primero como elemento, aunque ambos reconocieron a Courtois como el primero en aislarlo.
Gay-Lussac y las leyes de los gases

El químico francés Joseph Louis Gay-Lussac estudió las propiedades de los gases. En 1802, observó que todos los gases se expandían de forma proporcional al aumentar la temperatura, una conclusión que se conoce como ley de Charles. En 1804, Gay-Lussac realizó ascensos en globo para investigar los gases a grandes alturas.
En 1808, Gay-Lussac anunció que los gases, bajo las mismas condiciones de presión y temperatura, reaccionan entre sí en proporciones de volumen de números enteros y pequeños. Estas conclusiones se conocen como la ley de Gay-Lussac y la Ley de los volúmenes de combinación.
Gay-Lussac también descubrió el boro y participó en debates para modificar la definición de los ácidos.
Amedeo Avogadro y el número de moléculas

Después de la teoría atómica de Dalton en 1808, hubo mucha incertidumbre sobre cómo aplicar la teoría atómica. El físico italiano Amedeo Avogadro (1776-1856) propuso en 1811 que volúmenes iguales de cualquier gas, a la misma temperatura y presión, contenían el mismo número de moléculas. También razonó que los gases comunes no estaban formados por átomos solos, sino por moléculas con dos o más átomos. Esto resolvió un problema que Dalton y otros habían encontrado.
La hipótesis de Avogadro fue ignorada durante medio siglo. Sin embargo, a mediados del siglo, los químicos jóvenes como Alexander William Williamson, Charles Frédéric Gerhardt y August Kekulé comenzaron a proponer que la química teórica se ajustara a la teoría de Avogadro.
El inicio de la química orgánica y su industria
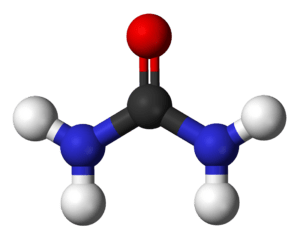
Clave de colores:
carbono • oxígeno
nitrógeno • hidrógenoDespués de entender la combustión, surgió un gran debate en química: el vitalismo, la idea de que la materia orgánica solo podía ser producida por seres vivos gracias a una "fuerza vital". En 1828, Friedrich Wöhler descubrió accidentalmente cómo sintetizar la urea a partir de sustancias inorgánicas, demostrando que la materia orgánica podía crearse químicamente. A pesar de esto, se mantiene la clasificación en química orgánica (que estudia los compuestos del carbono) y inorgánica (que estudia los demás elementos).
Friedrich Wöhler y Justus von Liebig realizaron en 1825 el primer descubrimiento de isómeros, que son moléculas con los mismos átomos pero dispuestos de forma diferente. También descubrieron y explicaron los grupos funcionales en la química orgánica.
Alfred Nobel se hizo rico con el descubrimiento de la dinamita. A su muerte, donó la mayor parte de su fortuna para los Premios Nobel.
La síntesis de la urea abrió el camino para la creación de cientos de productos orgánicos. El desarrollo de la química orgánica en la segunda mitad del siglo XIX fue impulsado por la búsqueda de nuevos colorantes sintéticos. En 1856, William Henry Perkin descubrió la mauveína, el primer colorante sintético, lo que dio origen a la industria de los tintes sintéticos.
Otra industria importante fue la de los explosivos. En 1847, Ascanio Sobrero descubrió la nitroglicerina, que era muy peligrosa. Alfred Nobel descubrió que al absorberla en una sustancia inerte, como la tierra de diatomeas, se volvía más segura y manejable. Patentó esta mezcla en 1867 con el nombre de dinamita.
En 1855, Benjamin Silliman Jr. inició los métodos de craqueo del petróleo, que son la base de la industria petroquímica actual, con productos como los plásticos y los carburantes. El primer plástico comercializado a gran escala, la baquelita, apareció a principios del siglo XX.
La fabricación industrial de medicamentos sintéticos comenzó con la aspirina en 1897.
El Congreso de Karlsruhe y la unificación de criterios
En 1840, Germain Henri Hess propuso la ley de Hess, que dice que la energía de una reacción solo depende de los reactivos iniciales y los productos finales. En 1848, William Thomson estableció el concepto de cero absoluto, la temperatura más baja posible. En 1849, Louis Pasteur descubrió que algunas sustancias tenían isómeros que giraban la luz en direcciones opuestas, iniciando el campo de la estereoquímica.

La hipótesis de Avogadro comenzó a ser aceptada después de que Stanislao Cannizzaro demostrara su valor en 1858. Cannizzaro explicó en un folleto que las ideas de Avogadro podían construir una teoría química sólida y consistente.
El verdadero impacto del trabajo de Cannizzaro se dio en el congreso de Karlsruhe en 1860, el primer congreso internacional de química. Cannizzaro fue muy claro en su exposición, y su folleto convenció a la mayoría de los asistentes. Así, Cannizzaro fue clave para que se adoptara la tesis de Avogadro, y el sistema de formulación y pesos atómicos resultante es, en esencia, el que se usa actualmente.
Espectroscopía y tubos de descarga

A mediados del siglo XIX, se crearon dos técnicas fundamentales para estudiar la estructura del átomo: la espectroscopía y los tubos de descarga. Entre 1859 y 1860, Robert Bunsen y Gustav Kirchhoff crearon el análisis de espectros. Los espectros atómicos son líneas que registran la energía emitida o absorbida por los átomos. Bunsen y Kirchoff usaron la espectroscopía para identificar nuevas sustancias, descubriendo el cesio y el rubidio.
Los tubos de descarga eran tubos de vidrio con poco gas en su interior. El químico y físico inglés William Crookes fue pionero en este campo, inventando el tubo de Crookes, con el que estudió los rayos catódicos. Sus investigaciones fueron fundamentales para la física atómica, ya que ayudaron a revelar la estructura del átomo. Crookes demostró que los rayos catódicos se movían en línea recta y producían luz al chocar con ciertas sustancias, lo que indicaba que estaban formados por partículas cargadas negativamente.
Kekulé y la estructura orgánica
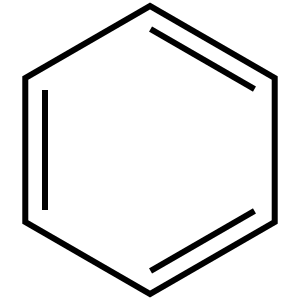
La contribución más importante del químico alemán Friedrich August Kekulé von Stradonitz fue su teoría estructural para los compuestos orgánicos, publicada en 1857 y 1858. Kekulé explicó que los átomos de carbono (que pueden formar cuatro enlaces) se unen entre sí para formar cadenas, y con el resto de sus enlaces pueden unirse a otros átomos como hidrógeno, oxígeno, nitrógeno y cloro.
En 1865, August Kekulé estableció la estructura del benceno, explicándola como un anillo de seis átomos de carbono con enlaces simples y dobles alternados. Esta propuesta fue muy debatida, pero nadie ofreció una mejor. Hoy sabemos que muchos compuestos orgánicos tienen estructuras cíclicas como el benceno.
Mendeléyev y la tabla periódica
En 1869, ya se habían descubierto 66 elementos y se había determinado su masa atómica. Se notó que algunos elementos tenían propiedades químicas similares. Varios científicos intentaron clasificarlos.
Pero quien dio sentido a la clasificación de los elementos fue Dmitri Ivanovich Mendeléyev al desarrollar la primera tabla periódica de los elementos moderna. Mendeléyev, un químico ruso, ordenó los 66 elementos conocidos en su tabla periódica por orden creciente de peso atómico, pero también considerando sus propiedades. Dejó huecos para elementos aún no descubiertos. Descubrió que al ordenar los elementos, se encontraban patrones recurrentes, o periodicidad, en sus propiedades. Publicó su descubrimiento en 1869. Su sistema le permitió predecir con bastante exactitud las propiedades de elementos que aún no se habían descubierto, como el escandio, galio y germanio, lo que llevó a la aceptación generalizada de su tabla.
Sin embargo, la tabla de Mendeléyev no era perfecta. Más tarde, se descubrió que algunos elementos no estaban en el orden correcto. La razón de esto la determinaría Henry Moseley más adelante: lo que realmente determina el patrón periódico de los átomos es el número de protones en su núcleo, o número atómico, y no la masa atómica.
Josiah Willard Gibbs y la termodinámica

La obra del físico estadounidense Josiah Willard Gibbs sobre la termodinámica fue fundamental para la química física. Entre 1876 y 1878, Gibbs aplicó los principios de la termodinámica a las reacciones químicas. Definió el potencial químico, que es la tendencia de una reacción química a ocurrir. En 1876, publicó su obra más famosa, Sobre el equilibrio de las substancias heterogéneas, donde desarrolló el concepto de energía libre para explicar el equilibrio químico.
Las ecuaciones de energía libre de Gibbs relacionan matemáticamente todas las variables de una reacción química (temperatura, presión, volumen, energía y entropía). Su contribución más destacada es la introducción del concepto de energía libre, por lo que una de sus formas se llama energía libre de Gibbs en su honor.
Van't Hoff y Arrhenius

En 1873, Jacobus Henricus van 't Hoff y Joseph Achille Le Bel desarrollaron un modelo de enlace químico que explicaba la quiralidad (moléculas que son imágenes especulares una de la otra). La publicación de van 't Hoff impulsó el desarrollo de la estereoquímica. En 1884, van 't Hoff publicó Estudios de química dinámica, un ensayo influyente sobre cinética química, donde explicó la relación entre el calor de reacción y el equilibrio químico.

En 1883, el científico sueco Svante Arrhenius desarrolló la teoría iónica para explicar la conductividad de los electrolitos. Propuso que algunas sustancias neutras se separaban en partículas cargadas (iones) al disolverse. En 1885, van 't Hoff demostró que las leyes de la termodinámica para los gases también podían aplicarse a las soluciones diluidas, lo que apoyó la teoría de Arrhenius.
Descubrimientos de finales del siglo XIX
En 1884, Hermann Emil Fischer propuso la estructura de la purina, una base de muchas biomoléculas.
En 1892, John Strutt y William Ramsay descubrieron el argón, el primero de los gases nobles. Al año siguiente, Ramsay descubrió el helio. En 1898, Ramsay y Morris Travers aislaron el neón, kriptón y xenón del aire licuado.
En 1897, Joseph John Thomson descubrió el electrón usando un tubo de rayos catódicos. En 1898, Wilhelm Wien demostró que los rayos canales (iones positivos) podían desviarse por campos magnéticos, lo que ayudó a entender la estructura del núcleo de los átomos.
Marie y Pierre Curie: la radioactividad

Pierre Curie y Marie Curie fueron científicos famosos por su investigación pionera en la radioactividad. Su trabajo, junto con el de Henri Becquerel, fue fundamental para la era nuclear. Marie Curie descubrió que la emisión de rayos del uranio era una propiedad del propio metal, independiente de su estado químico o físico. A este fenómeno lo llamaron radioactividad.

Trabajando con la pechblenda (un mineral de uranio), los Curie descubrieron dos nuevos elementos radiactivos: el polonio (en honor al país de origen de Marie) y el radio. En 1902, lograron obtener un decigramo de radio puro. Los Curie, junto a Henri Becquerel, recibieron el Premio Nobel de física en 1903 por su estudio de la radiactividad. Marie Curie recibió el Premio Nobel de química en 1911 por el descubrimiento del radio y el polonio. Fue la primera mujer en recibir un Premio Nobel y la única persona en recibir dos Premios Nobel en dos disciplinas científicas diferentes.
Pierre Curie también estudió la radiación de los nuevos elementos y observó los efectos físicos del radio, abriendo el camino para la radioterapia.
Siglo XX: se revela la estructura del átomo

A principios del siglo XX, surgieron varios modelos atómicos para mejorar la teoría atómica de Dalton. En 1903, Joseph John Thomson propuso que los electrones se distribuían uniformemente en el átomo, como pasas en un pudín.

En 1903, el botánico ruso Mijaíl Tsvet inventó la cromatografía, una técnica importante para la química analítica que separa sustancias en mezclas complejas.
En 1905, Fritz Haber y Carl Bosch desarrollaron el proceso de Haber para fabricar amoniaco a gran escala, lo que tuvo grandes consecuencias en la producción de fertilizantes.
En 1905, Albert Einstein explicó el movimiento browniano, lo que apoyó definitivamente la teoría atómica. En 1907, Leo Baekeland inventó la baquelita, el primer plástico comercializado con éxito.
En 1909, Robert Andrews Millikan midió con gran precisión la carga del electrón, confirmando que todos los electrones tenían la misma carga y masa. El mismo año, S. P. L. Sørensen inventó el concepto de pH para medir la acidez.
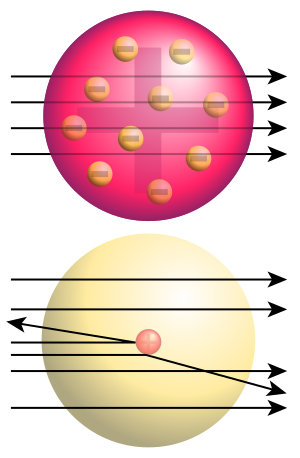
Arriba: el resultado previsto si hubiera sido válido el modelo atómico de Thomson. Abajo: el resultado del experimento que demostró la existencia de un núcleo central positivo en el átomo.
Ernest Rutherford y su modelo atómico
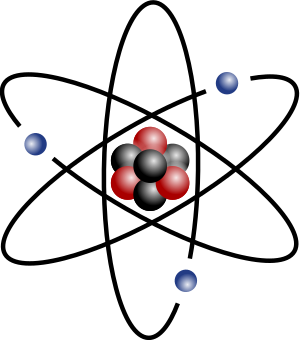
El físico Ernest Rutherford es considerado el padre de la física nuclear. Estudió y clasificó las partículas radiactivas, dándoles nombre (rayos α, β y γ). Demostró que la radioactividad se debía a la transformación de los átomos, lo que hoy conocemos como reacciones nucleares.
En 1906, Rutherford dirigió un experimento en el que se bombardeó una lámina de oro muy fina con partículas alfa. Los resultados sorprendieron a Rutherford: aunque muchas partículas pasaron sin desviarse, un pequeño porcentaje se desvió mucho. Esto demostró que en el átomo había una masa relativamente grande con carga positiva, a la que Rutherford llamó núcleo atómico. A partir de esto, Rutherford desarrolló su propio modelo atómico, según el cual el átomo tenía un núcleo central positivo y electrones girando a su alrededor, pero la mayor parte del átomo estaba vacía. Rutherford recibió el Premio Nobel de química en 1908.
Modelo atómico de Bohr
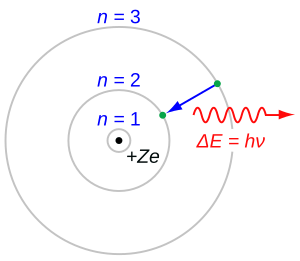
El modelo de Rutherford tenía un problema: según la teoría clásica, los electrones que giran deberían perder energía y caer al núcleo. En 1913, el físico danés Niels Bohr resolvió esto introduciendo el concepto de cuantización. Propuso en su modelo atómico que los electrones solo podían girar en órbitas específicas, llamadas órbitas estacionarias, donde no emitían energía.
En el modelo de Bohr, los electrones se mueven en órbitas circulares alrededor del núcleo en niveles cuantizados. Los electrones emiten o absorben energía para pasar a órbitas más bajas o altas. El éxito de este modelo fue que las líneas del espectro de emisión del hidrógeno coincidían perfectamente con lo que él predijo.
Isótopos, protones, neutrones y modelo de Sommerfeld
En 1913, Henry Moseley introdujo el concepto de número atómico para corregir la tabla periódica de Mendeléyev. El mismo año, Frederick Soddy formuló el concepto de isótopo, diciendo que existían elementos con la misma química pero diferente peso atómico.
En 1918, Ernest Rutherford descubrió el protón, al observar que los núcleos de hidrógeno eran partículas fundamentales. En 1920, Rutherford propuso la existencia de partículas neutras en el núcleo para explicar por qué los protones no se separaban. Finalmente, James Chadwick descubrió el neutrón en 1932, una partícula nuclear con masa similar al protón pero sin carga. Este descubrimiento explicó los desajustes de la tabla periódica y la existencia de los isótopos (átomos con el mismo número de protones pero diferente número de neutrones).
En 1916, Arnold Sommerfeld mejoró el modelo de Bohr, introduciendo órbitas elípticas.
Gilbert N. Lewis y los enlaces químicos

El físico químico estadounidense Gilbert Newton Lewis inició la teoría del enlace de valencia. Esta teoría dice que los enlaces químicos dependen de los electrones en la capa más externa de los átomos. En 1916, Lewis propuso que un enlace químico se forma cuando dos electrones se comparten entre dos átomos. Introdujo los "diagramas de electrones de puntos", conocidos como estructuras de Lewis, que se usan para representar las estructuras electrónicas de átomos y moléculas.
Lewis también desarrolló en 1923 la teoría de los pares de electrones libres para los ácidos y bases. Redefinió el concepto de ácido como cualquier átomo o molécula que puede aceptar un par de electrones, y las bases como sustancias que pueden donar un par de electrones.
La mecánica cuántica
|
||||
| De izq. a dcha. y de arriba abajo: Louis de Broglie (1892-1987). Wolfgang Pauli (1900-1958). Erwin Schrödinger (1887-1961). Werner Heisenberg (1901-1976). |
En la década de 1920, se establecieron las bases de la mecánica cuántica, que sería clave para entender la naturaleza y el comportamiento de las partículas subatómicas.
En 1924, el físico Louis de Broglie propuso que el electrón se comporta como una onda y como una partícula. Esto explicaba las restricciones de movimiento de los electrones dentro del átomo.
En 1925, el físico austriaco Wolfgang Pauli estableció el principio de exclusión de Pauli, que dice que dos electrones en el mismo átomo no pueden ocupar el mismo estado cuántico al mismo tiempo.
En 1926, Erwin Schrödinger creó la ecuación de Schrödinger, la ecuación básica de la mecánica cuántica. Las soluciones de esta ecuación son funciones de onda que describen la probabilidad de que ocurra un evento físico. Con el modelo atómico de Schrödinger, los electrones ya no se describen en órbitas, sino en orbitales.
Werner Heisenberg también fue clave en la mecánica cuántica. En 1927, publicó su principio de incertidumbre, que demostró que no se puede conocer al mismo tiempo la posición y la velocidad de un electrón.
En 1928, Paul Dirac formuló la ecuación de Dirac, que es consistente con la mecánica cuántica y la teoría de la relatividad especial.
Al darse cuenta de que los átomos no eran indivisibles y que las partículas subatómicas se comportaban como ondas, el estudio de la estructura interna del átomo pasó a ser parte de la física.
Química cuántica
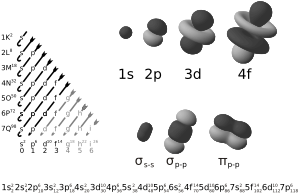
Una vez que se entendieron los principios de la mecánica cuántica, surgió la química cuántica para aplicarlos al estudio de los enlaces químicos y las estructuras de las moléculas. Se descubrió que las propiedades químicas estaban determinadas por las estructuras electrónicas de los átomos y sus compuestos.

En 1951, Clemens C. J. Roothaan publicó un artículo que abrió el camino para resolver las ecuaciones de la química cuántica para moléculas pequeñas. Los avances en la informática facilitaron la resolución de estas ecuaciones.
La teoría de los orbitales moleculares se desarrolló alrededor de 1927, principalmente por Friedrich Hund y Robert Mulliken.
En los años 1940, muchos físicos se dedicaron a la física nuclear. En esta época, Glenn T. Seaborg aisló e identificó elementos transuránicos, siendo codescubridor de 10 de ellos.
Mark Oliphant y el descubrimiento de la fusión nuclear
En 1932, Mark Oliphant observó por primera vez la fusión nuclear de núcleos ligeros (isótopos de hidrógeno), gracias a los estudios de Ernest Rutherford. La investigación sobre la fusión para fines civiles comenzó en la década de 1950 y continúa hasta hoy.
Bioquímica y biología molecular
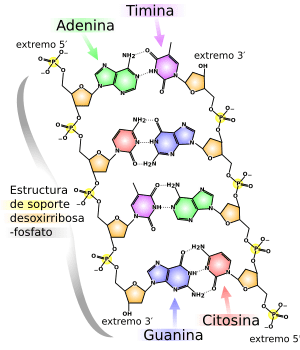
A principios de la década de 1940, la química y la física habían logrado explicar las propiedades químicas basándose en la configuración electrónica del átomo. El libro de Linus Pauling La naturaleza del enlace químico (1939) usó la química cuántica para deducir los ángulos de los enlaces en moléculas complejas.
En la década de 1940, el químico estadounidense Melvin Calvin investigó la fotosíntesis, usando marcadores radiactivos de carbono 14. Descubrió la secuencia de reacciones químicas que usan las plantas para transformar dióxido de carbono y agua en oxígeno e hidratos de carbono, lo que se conoce como ciclo de Calvin.
En 1937, Hans Adolf Krebs descubrió que todas las reacciones de la respiración celular estaban relacionadas, llamando a esta secuencia ciclo de Krebs.
La mayoría de los aminoácidos, que son los componentes de las proteínas, se descubrieron entre 1819 y 1904. En 1953, el experimento de Miller y Urey demostró que los aminoácidos podían formarse a partir de moléculas inorgánicas simples en condiciones similares a las de la Tierra primitiva.
También en 1953, James Watson y Francis Crick dedujeron la estructura de doble cadena helicoidal del ADN, lo que impulsó el campo de la bioquímica. En 1983, Kary Mullis desarrolló la reacción en cadena de la polimerasa (PCR), que revolucionó la manipulación del ADN en los laboratorios y permitió la secuenciación del ADN de los organismos.
Finales del siglo XX
En 1970, John Pople creó el programa Gaussian, que facilitó los cálculos de la química computacional.
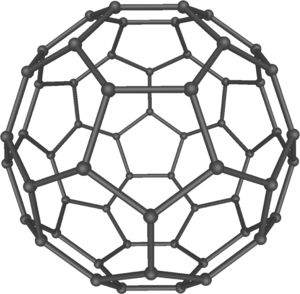
En 1985, Harold Kroto, Robert Curl y Richard Smalley descubrieron los fullerenos, una clase de grandes moléculas de carbono con forma de poliedros. En 1991, Sumio Iijima descubrió los nanotubos, un tipo de fullereno cilíndrico, que son importantes en la nanotecnología.
En 1995, Eric Cornell y Carl Wieman produjeron el primer Condensado de Bose-Einstein, un estado de agregación de la materia predicho por la mecánica cuántica.
Galería de imágenes
Véase también
 En inglés: History of chemistry Facts for Kids
En inglés: History of chemistry Facts for Kids