Fermio para niños
Datos para niños Einstenio ← Fermio → Mendelevio |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Fermio, Fm, 100 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Actínidos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | actínidos, 7, f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 257 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Rn] 5f12 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 32, 30, 8, 2 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Metal plateado | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Desconocida | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del fermio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El fermio es un elemento químico especial que no se encuentra en la naturaleza. Es un elemento radiactivo y fue creado por científicos. Su número atómico es 100 y su símbolo es Fm.
Existen 16 tipos diferentes de fermio, llamados isótopos. El más estable es el fermio-257, que dura unos 100.5 días antes de transformarse. El fermio pertenece a un grupo de elementos llamados actínidos en la tabla periódica.
Fue descubierto en 1952 por el químico estadounidense Albert Ghiorso y su equipo. Lo encontraron en los restos de una gran explosión científica. Más tarde, también se logró crear fermio en un reactor nuclear y en un ciclotrón.
El nombre "fermio" se le dio en 1955 en honor a Enrico Fermi, un famoso físico nuclear. Este elemento no se usa en la industria.
Contenido
¿Cómo se descubrió el Fermio?


El fermio fue descubierto en los materiales que cayeron al suelo después de una gran explosión científica llamada 'Ivy Mike'. Esta explosión ocurrió el 1 de noviembre de 1952. Al principio, los científicos encontraron un nuevo tipo de plutonio en los restos. Se dieron cuenta de que este plutonio se había formado cuando el uranio-238 absorbió muchos neutrones.
Esto hizo pensar a los científicos que el uranio podría absorber aún más neutrones, creando elementos completamente nuevos.
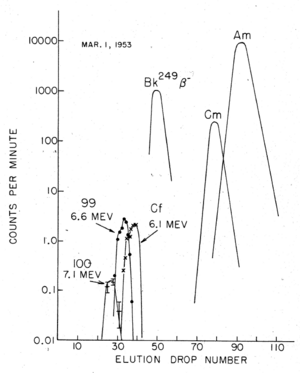
Primeros hallazgos del elemento 99
Poco después, el elemento 99, llamado einstenio, fue descubierto en filtros de aire que habían pasado por la nube de la explosión. En diciembre de 1952, Albert Ghiorso y sus colegas de la Universidad de California en Berkeley identificaron el isótopo einstenio-253. Este se formó cuando el uranio-238 capturó 15 neutrones y luego cambió siete veces.
Algunos átomos de uranio-238 pudieron haber capturado incluso más neutrones, quizás 16 o 17.
El descubrimiento del Fermio
Para encontrar el fermio (el elemento 100), se necesitaba más material. Se esperaba que hubiera menos fermio que einstenio. Por eso, se enviaron corales contaminados del atolón de Enewetak (donde ocurrió la explosión) al Laboratorio de Radiación de la Universidad de California.
Unos dos meses después de la explosión, se encontró un nuevo elemento. Este elemento liberaba partículas de alta energía y duraba aproximadamente un día. Los científicos se dieron cuenta de que debía ser un isótopo del elemento 100, y lo identificaron como fermio-255.
Información clasificada y reconocimiento
Al principio, el descubrimiento de estos nuevos elementos se mantuvo en secreto por razones de seguridad nacional hasta 1955. Sin embargo, el equipo de Berkeley logró crear los elementos 99 y 100 de forma pacífica, bombardeando plutonio-239 con neutrones. Publicaron su trabajo en 1954.
En 1955, la información sobre la explosión 'Ivy Mike' se hizo pública. El equipo de Berkeley quería nombrar el nuevo elemento antes de que otros grupos lo hicieran. Un grupo en Suecia también descubrió un isótopo del elemento 100, el fermio-250, en mayo de 1954. Sin embargo, se reconoció la prioridad del equipo de Berkeley. Por eso, tuvieron el derecho de nombrar el nuevo elemento en honor a Enrico Fermi, quien había creado el primer reactor nuclear que funcionaba por sí mismo.
Características del Fermio
El fermio no existe en la naturaleza. Solo se puede crear en laboratorios a partir de elementos más ligeros. Se han encontrado isótopos radiactivos de fermio con masas que van desde 244 hasta 259. La cantidad total de fermio que se ha creado es muy, muy pequeña, menos de una millonésima de gramo.
Algunos isótopos de fermio, como el fermio-244, fermio-256 y fermio-258, se desintegran principalmente por un proceso llamado fisión espontánea. Esto significa que sus núcleos se dividen solos. El isótopo que dura más tiempo es el fermio-257, con una vida media de unos 100 días. El fermio-258 se desintegra muy rápido, en menos de un milisegundo. Esto sugiere que hay algo especial en esta parte de la tabla periódica.
Producción del Fermio
El fermio se produce bombardeando actínidos más ligeros con neutrones dentro de un reactor nuclear. El fermio-257 es el isótopo más pesado que se puede obtener de esta manera, pero solo se produce en cantidades muy pequeñas, como picogramos (una billonésima parte de un gramo).
La principal fuente para producir fermio es el High Flux Isotope Reactor (HFIR) en el Oak Ridge National Laboratory en Tennessee, Estados Unidos. Este reactor se dedica a crear elementos más pesados que el curio (elementos transcurio). Los isótopos de fermio más ligeros, como el fermio-254 y el fermio-255, se pueden obtener en mayores cantidades, pero duran menos tiempo.
En una producción típica en Oak Ridge, se usan gramos de curio para obtener cantidades más pequeñas de californio, berkelio, einstenio y, finalmente, picogramos de fermio. Se cree que las explosiones científicas grandes pueden producir miligramos de fermio, aunque mezclado con muchos otros materiales. Por ejemplo, se recuperaron 4.0 picogramos de fermio-257 de 10 kg de restos de una explosión llamada "Hutch" en 1969.
Después de producir el fermio, es necesario separarlo de otros elementos. Esto se hace usando una técnica llamada cromatografía, que ayuda a separar los diferentes elementos.
Aunque el fermio-257 es el isótopo más estable, la mayoría de los estudios se hacen con fermio-255. Esto es porque el fermio-255 es más fácil de obtener, ya que se forma a partir de la desintegración del einstenio-255.
Química del Fermio
La química del fermio se ha estudiado solo en soluciones y en cantidades muy pequeñas. No se han logrado crear compuestos sólidos de fermio. En condiciones normales, el fermio existe en solución como un ion Fm3+. Este ion se une a muchas moléculas de agua.
El ion Fm3+ forma uniones con otras sustancias que tienen átomos "donantes" fuertes, como el oxígeno. Estas uniones suelen ser más estables que las de los elementos actínidos anteriores. También forma uniones con iones negativos como el cloruro o el nitrato, y estas uniones también parecen ser más estables.
Se cree que las uniones en los últimos actínidos son principalmente de tipo iónico. El ion Fm3+ es más pequeño que los iones de actínidos anteriores. Esto se debe a que el fermio tiene una carga nuclear efectiva mayor, lo que hace que sus uniones sean más cortas y fuertes.
El fermio(III) puede transformarse fácilmente en fermio(II). Por ejemplo, si se mezcla con [[cloruro de samario(II)], el fermio(II) se precipita (se separa de la solución). En este precipitado, se forma un compuesto llamado cloruro de fermio(II) (FmCl2), aunque no se ha logrado purificarlo ni estudiarlo por separado.
Véase también
 En inglés: Fermium Facts for Kids
En inglés: Fermium Facts for Kids