Circonio para niños
Datos para niños Itrio ← Circonio → Niobio |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Circonio, Zr, 40 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Metales de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período | 4, 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 91,224 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Kr] 4d2 5s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Mohs | 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 10, 2 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Blanco grisáceo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 155 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,33 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 206 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 148 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 4 (anfótero) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 640,1 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 1270 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª energía de ionización | 2218 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª energía de ionización | 3313 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5.ª energía de ionización | 7752 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6.ª energía de ionización | 9500 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 6501 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 2128 K (1855 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 4644 K (4371 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 58,2 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 16,9 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 0,00168 Pa a 2125 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Hexagonal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 0,27 J/(kg·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | 2,36·106 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 22,7 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 3800 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del circonio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El circonio (símbolo Zr) es un elemento químico con el número atómico 40. Se encuentra en el grupo 4 de la tabla periódica de los elementos. Su nombre viene del mineral circón, que a su vez proviene de la palabra persa "zargun", que significa "dorado".
Es un metal de transición de color blanco grisáceo y brillante. Es muy duro y resistente a la corrosión, pareciéndose al acero. Los minerales más importantes donde se encuentra son el circón y la baddeleyita. Estos minerales suelen contener también hafnio, un elemento muy similar al circonio.
El circonio se usa mucho en reactores nucleares porque no absorbe muchos neutrones. También se usa en materiales que soportan altas temperaturas (refractarios) y para hacer cosas opacas. Además, se emplea como material abrasivo y en pequeñas cantidades para hacer aleaciones más resistentes a la corrosión.
Contenido
Descubrimiento del Circonio
El circonio fue descubierto en 1789 por Martin Heinrich Klaproth. Él lo encontró en el mineral circón, una piedra preciosa conocida desde hace mucho tiempo. En 1824, Jöns Jacob Berzelius logró aislar el circonio, pero no estaba completamente puro. El metal puro no se obtuvo hasta 1914.
Antiguos escritos ya mencionaban el mineral circón. Sin embargo, no se sabía que contenía un nuevo elemento hasta que Klaproth lo estudió. Berzelius lo aisló usando un proceso químico.
Por mucho tiempo, no se pudo determinar la masa atómica exacta del circonio. Esto se debía a que el circonio natural siempre tiene pequeñas cantidades de hafnio mezcladas. La primera vez que se usó el circonio de forma práctica fue en los flashes de las cámaras de fotos.
Propiedades del Circonio
Propiedades Físicas del Circonio
El circonio es un metal sólido a temperatura ambiente. Es de color blanco grisáceo y tiene un brillo especial. Es un metal pesado, pero más ligero que el acero, y su dureza es parecida a la del cobre.
El circonio se funde a 1855 °C y hierve a 4371 °C. Es un metal que no atrae mucho los electrones (su electronegatividad es baja). De los elementos de su grupo, el circonio tiene la cuarta electronegatividad más baja.
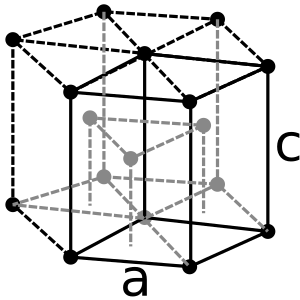
A temperatura ambiente, el circonio tiene una forma cristalina hexagonal. Si se calienta a 863 °C, cambia a una forma cúbica. El circonio mantiene esta forma cúbica hasta que se funde.
Las mezclas de circonio con zinc se vuelven magnéticas a temperaturas muy bajas. El ZrZn2 es especial porque puede ser superconductor y magnético al mismo tiempo. Por debajo de 0.55 K, el circonio puro también es superconductor.
Cuando el circonio es puro, es fácil de moldear y estirar. Pero si tiene pequeñas cantidades de hidrógeno, carbono o nitrógeno, se vuelve frágil. No es un buen conductor de electricidad, solo conduce el 4% de lo que conduce el cobre. Sin embargo, es un buen conductor del calor.
Las propiedades del circonio son muy parecidas a las del hafnio. Esto se debe a que sus átomos tienen un tamaño similar. Sin embargo, se diferencian mucho en su densidad.
Una propiedad muy importante del circonio es que absorbe muy pocos neutrones. Por eso es ideal para reactores nucleares. El hafnio, en cambio, absorbe muchos neutrones, por lo que deben separarse para estas aplicaciones.
Propiedades Químicas del Circonio
El circonio suele formar compuestos con un estado de oxidación de +4.
El circonio forma una capa delgada de óxido en su superficie. Esta capa lo protege y lo hace muy resistente a la corrosión. No reacciona fácilmente con álcalis, ácidos o agua salada. Sin embargo, el ácido fluorhídrico puede disolverlo.
Si el circonio está en polvo muy fino, puede encenderse fácilmente en el aire, sobre todo a altas temperaturas. Esto ocurre porque reacciona con el nitrógeno y el oxígeno. Pero si está en una pieza sólida, es mucho más difícil que se encienda.
Isótopos del Circonio
El circonio que encontramos en la naturaleza tiene cuatro isótopos estables: 90Zr, 91Zr, 92Zr y 94Zr. También tiene un radioisótopo llamado 96Zr, que dura muchísimo tiempo. El 90Zr es el más común, representando más de la mitad del circonio natural.
Los científicos han creado 28 isótopos artificiales de circonio. Algunos de ellos duran muy poco tiempo, como el 110Zr, que solo existe por milisegundos. Otros, como el 93Zr, pueden durar más de un millón de años.
Usos del Circonio
El circonio tiene muchas aplicaciones importantes:
- Se usa principalmente (casi el 90%) en reactores nucleares. Se mezcla con otros elementos para formar una aleación llamada zircaloy. Esta aleación es resistente a la corrosión y no absorbe muchos neutrones. Para esto, es muy importante separar el circonio del hafnio.
- Se añade a los aceros para hacerlos más resistentes. También se usa en la industria química para fabricar válvulas, bombas y tuberías que resisten sustancias corrosivas.
- El óxido de circonio se usa para hacer recipientes de laboratorio que aguantan cambios bruscos de temperatura. También se emplea como material resistente al calor en las industrias cerámica y del vidrio.
- El óxido de circonio se utiliza en odontología para hacer prótesis dentales. También se usa para reemplazar articulaciones en el cuerpo, ya que es un material seguro y compatible.
- Se emplea en intercambiadores de calor y en algunos tipos de bombillas.
- En el ámbito militar, se usa en ciertos tipos de municiones que producen un efecto incendiario.
- Cuando se mezcla con niobio, el circonio se vuelve superconductor a bajas temperaturas. Esto permite crear imanes muy potentes.
- El óxido de circonio se usa en joyería para crear una gema artificial llamada circonita, que se parece mucho al diamante.
- También se utiliza para fabricar cuchillos y herramientas de corte muy resistentes y duraderas.
- Se añade para crear arenas sintéticas.
¿Dónde se encuentra el Circonio?
El circonio no se encuentra puro en la naturaleza, pero sí forma parte de muchos minerales. En la corteza terrestre, hay unos 130 miligramos de circonio por cada kilogramo de tierra. En el agua de mar, hay una cantidad mucho menor.
Aunque es bastante común, el circonio suele encontrarse en cristales muy pequeños. Por eso, antes se pensaba que era un elemento raro. Se halla principalmente en rocas ígneas como el granito.
La principal fuente de circonio es el mineral circón. Este mineral se encuentra en grandes cantidades en Australia, Brasil, India, Rusia y Estados Unidos. Australia y Sudáfrica producen el 80% del circón mundial. Se estima que hay más de 60 millones de toneladas de circón en el mundo.
El circón se obtiene a menudo como un subproducto de la minería de otros metales, como el titanio y el estaño. El circonio y el hafnio suelen estar juntos en el circón y son muy difíciles de separar.
También se ha encontrado mucho óxido de circonio en las muestras de rocas lunares que trajo el programa Apolo.
Cómo se produce el Circonio
El circón se obtiene de la minería de minerales de titanio y estaño. Después de extraerlo, la arena que contiene circonio se limpia para quitar los materiales más ligeros. Luego, se usan imanes para separar el circón de otros minerales.
La mayor parte del circón se usa directamente, pero una pequeña parte se convierte en metal. Para obtener el metal, primero se transforma el circón en dióxido de circonio. Luego, se usa un proceso llamado "proceso Kroll" para reducir el cloruro de circonio con magnesio.
Para obtener circonio muy puro, se usa otro método llamado "proceso de Van Arkel-de Boer". Este proceso calienta el circonio con yodo para formar un compuesto, que luego se descompone para dejar el circonio puro.
El circonio que se usa en la industria siempre tiene un poco de hafnio mezclado. Esto no es un problema para la mayoría de los usos. Sin embargo, para los reactores nucleares, el hafnio debe ser eliminado.
Separación de Circonio y Hafnio
Es muy importante separar el hafnio del circonio para las aplicaciones nucleares. Esto se debe a que el hafnio absorbe muchísimos más neutrones que el circonio. Hay varios métodos para separarlos, como la extracción con líquidos o la cristalización. El hafnio que se separa se puede usar para las barras de control de los reactores nucleares.
Seguridad con el Circonio
Los compuestos de circonio no son muy comunes y no son muy tóxicos. Sin embargo, el polvo de circonio muy fino puede encenderse fácilmente en el aire si hay calor. Por eso, hay que tener cuidado con él, ya que puede causar incendios o explosiones. Es importante saber que muchos metales en polvo fino tienen este mismo riesgo. No se conoce que el circonio tenga algún papel importante en los seres vivos.
Véase también
 En inglés: Zirconium Facts for Kids
En inglés: Zirconium Facts for Kids