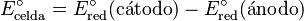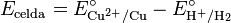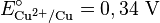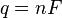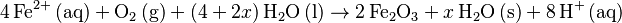Electroquímica para niños
La electroquímica es una parte de la química que estudia cómo la energía eléctrica y la energía química se transforman una en la otra. Es decir, investiga las reacciones químicas que ocurren en el punto donde un conductor eléctrico (como un metal) se encuentra con un conductor iónico (como una disolución o, a veces, un sólido).
Cuando una diferencia de potencial (como el voltaje de una pila) provoca una reacción química, a esto se le llama electrólisis. Por otro lado, si una reacción química produce electricidad, se le conoce como una batería o celda galvánica.
Las reacciones químicas donde los electrones se mueven de una molécula a otra se llaman reacciones redox. Son muy importantes en la electroquímica porque son la base de los procesos que generan electricidad o que son causados por ella.
En general, la electroquímica se encarga de estudiar las situaciones donde las reacciones de oxidación (pérdida de electrones) y reducción (ganancia de electrones) ocurren en lugares o momentos separados, pero conectados por un circuito eléctrico.
Contenido
Historia de la electroquímica
El camino para el nacimiento de la electroquímica fue preparado por científicos como Charles-Augustin de Coulomb con su teoría de atracción electrostática en 1781, y los estudios de Henry Cavendish, Joseph Priestley y Humphry Davy.
A finales del siglo XVIII, el médico italiano Luigi Galvani hizo un descubrimiento importante. Notó que al pasar electricidad por las ancas de rana, los músculos se movían. También observó algo similar al tocar los nervios con un escalpelo. En 1791, Galvani sugirió que existía una sustancia "nervio-eléctrica" en todos los seres vivos.
Galvani pensó que esta era una nueva forma de electricidad natural, diferente a la de los truenos y relámpagos o la de animales como la anguila eléctrica o las rayas eléctricas.

Más tarde, Alessandro Volta creó la primera batería moderna, lo que impulsó el estudio de la electroquímica. Durante la Revolución Industrial, científicos como William Nicholson y Johann Wilhelm Ritter sentaron las bases de la galvanoplastia (cubrir un metal con otro usando electricidad). Años después, Thomas Johann Seebeck descubrió la termoelectricidad.
A mediados del siglo XIX, Michael Faraday (con sus leyes de la electrólisis) y John Daniell (con la pila de zinc-cobre) ayudaron a entender mejor la electroquímica. Hacia finales de siglo, Svante August Arrhenius y Friedrich Ostwald estudiaron cómo los electrolitos conducen la electricidad, y Walther Hermann Nernst desarrolló modelos matemáticos para las baterías.
Desde el siglo XX, la electroquímica ha permitido grandes avances, como el descubrimiento de la carga del electrón por Millikan y el desarrollo de la teoría moderna de ácidos y bases por Brønsted y Lowry. También ha sido clave en campos como la medicina y la biología, con técnicas como la electroforesis, desarrollada por Arne Tiselius en 1937.
Hoy en día, la electroquímica se relaciona con muchos temas, desde la electroquímica cuántica hasta las celdas fotovoltaicas (paneles solares) y la quimioluminiscencia (luz producida por reacciones químicas).
Principios de la electroquímica
Reacciones de reducción-oxidación (redox)
Las reacciones de reducción-oxidación son reacciones químicas donde los electrones se transfieren. Esto ocurre entre dos sustancias: una que se oxida (pierde electrones) y otra que se reduce (gana electrones). En estas reacciones, la energía que se libera de una reacción que ocurre por sí sola se convierte en electricidad, o bien, se usa para hacer que ocurra una reacción que normalmente no pasaría.
Cómo balancear ecuaciones redox
Las reacciones electroquímicas se pueden balancear usando el método ion-electrón. Este método divide la reacción principal en dos partes, llamadas semirreacciones: una de oxidación y otra de reducción. Luego, se ajustan los átomos y las cargas añadiendo H+, OH−, H2O o electrones.
Es importante saber si la reacción ocurre en un medio ácido o básico, ya que el proceso de balanceo cambia.
En medio ácido
Veamos un ejemplo con una sal de magnesio y bismutato de sodio.
- Primero, escribimos la reacción sin balancear:
- <chem> Mn^{2+} (aq) + NaBiO3 (s) -> Bi^{3+} (aq) + MnO4^{-} (aq)</chem>
- Luego, la dividimos en dos semirreacciones:
- Semirreacción de oxidación: <chem>Mn^{2+} (aq) -> MnO4^{-} (aq) </chem>
- Semirreacción de reducción: <chem> BiO3^- (s) -> Bi^{3+} (aq) </chem>
- Balanceamos cada semirreacción. En medio ácido, añadimos H+ para balancear los átomos de H y H2O para balancear los átomos de O.
- Semirreacción de oxidación: <chem> 4 H2O (l) + Mn^{2+} (aq) -> MnO4^- (aq) + 8 H^+ (aq) + 5 e^- </chem>
- Semirreacción de reducción: <chem> 2 e^- + 6 H^+ (aq) + BiO_3^- (s) -> Bi^{3+} (aq) + 3 H2O (l) </chem>
- Finalmente, multiplicamos cada semirreacción por un número para que los electrones se cancelen al sumarlas.
- Semirreacción de oxidación: <chem> 8 H2O (l) + 2 Mn^{2+} (aq) -> 2 MnO4^- (aq) + 16 H^+ (aq) + 10 e^- </chem>
- Semirreacción de reducción: <chem> 10 e^- + 30 H^+ (aq) + 5 BiO3^- (s) -> 5 Bi^{3+} (aq) + 15 H2O (l) </chem>
- La reacción balanceada es:
- <chem> 14 H^+ (aq) + 2 Mn^{2+} (aq) + 5 NaBiO3 (s) -> 7 H2O (l) + 2 MnO4^- (aq) + 5 Bi^{3+} (aq) + 5 Na^+ (aq) </chem>
En medio básico
Veamos un ejemplo con permanganato de potasio y sulfito de sodio.
- Primero, escribimos la reacción sin balancear:
- <chem> KMnO4 + Na2SO3 + H2O -> MnO2 + Na2SO4 + KOH </chem>
- Luego, la dividimos en dos semirreacciones:
- Semirreacción de reducción: <chem> MnO4^- -> MnO2 </chem>
- Semirreacción de oxidación: <chem> SO3^{2-} -> SO4^{2-} </chem>
- Balanceamos cada semirreacción. En medio básico, añadimos OH− para balancear los átomos de H y H2O para balancear los átomos de O.
- Semirreacción de reducción: <chem> 3 e^- + 2 H2O + MnO4^- -> MnO2 + 4 OH^- </chem>
- Semirreacción de oxidación: <chem> 2 OH^- + SO3^{2-} -> SO4^{2-} + H2O + 2 e^- </chem>
- Finalmente, multiplicamos cada semirreacción por un número para que los electrones se cancelen al sumarlas.
- Semirreacción de reducción: <chem> 6 e^- + 4 H2O + 2 MnO4^- -> 2 MnO2 + 8 OH^- </chem>
- Semirreacción de oxidación: <chem> 6 OH^- + 3 SO3^{2-} -> 3 SO4^{2-} + 3 H2O + 6 e^- </chem>
- La ecuación balanceada es:
- <chem> 2 KMnO4 + 3 Na2SO3 + H2O -> 2 MnO2 + 3 Na2SO4 + 2 KOH </chem>
Transporte de sustancias
En los sistemas electroquímicos, las sustancias se mueven de tres maneras principales:
- Difusión: Es el movimiento de las sustancias de un lugar con mucha concentración a uno con menos. En las reacciones electroquímicas, esto ocurre porque las reacciones redox crean nuevas sustancias en la superficie del electrodo.
- Migración: Es el movimiento de partículas con carga (iones) debido a diferencias de potencial eléctrico. Los iones se mueven a través de la solución entre los electrodos para equilibrar la corriente de electrones.
- Convección: Es el movimiento de las sustancias debido a fuerzas externas, como agitar la solución o mover el electrodo. Si no hay agitación, la convección natural puede ocurrir por pequeñas diferencias de densidad causadas por los cambios químicos.
Celdas electroquímicas
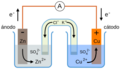
Una celda electroquímica es un aparato que usa corriente eléctrica para descomponer sustancias ionizadas (electrolitos) o que produce electricidad a partir de reacciones químicas. También se le llama celda galvánica o voltaica en honor a Luigi Galvani y Alessandro Volta, quienes crearon las primeras a finales del siglo XVIII.
Las celdas electroquímicas tienen dos partes importantes: el ánodo y el cátodo. El ánodo es donde ocurre la oxidación (pérdida de electrones), y el cátodo es donde ocurre la reducción (ganancia de electrones). Los electrodos pueden ser de cualquier material que conduzca electricidad, como metales o semiconductores. El grafito también se usa mucho por su buena conductividad y bajo costo.
Para que el circuito eléctrico esté completo, las soluciones se conectan con un conductor llamado puente de sal (o puente salino), por donde pasan los iones. Los iones positivos (cationes) se mueven hacia el cátodo, y los iones negativos (aniones) hacia el ánodo.
La electricidad fluye del ánodo al cátodo porque hay una diferencia de potencial eléctrico entre ellos. Esta diferencia se mide con un voltímetro y se llama voltaje de la celda, fuerza electromotriz (fem) o potencial de celda.
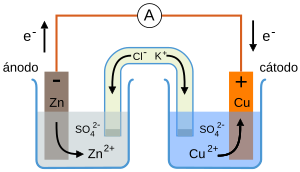
Un ejemplo famoso es la Pila Daniell, que tiene un ánodo de cinc y un cátodo de cobre, ambos sumergidos en soluciones de sus sulfatos y conectados por un puente salino. Sus reacciones son:
- Reacción en el ánodo: <chem> Zn (s) -> Zn^{2+}(aq) + 2 e^- \,</chem>
- Reacción en el cátodo: <chem> Cu^{2+} (aq) + 2 e^- -> Cu (s)\,</chem>
- Reacción total: <chem> Zn (s) + Cu^{2+} (aq) -> Cu (s)+Zn^{2+} (aq)\,</chem>
Para representar una celda electroquímica de forma sencilla, se usa un diagrama de celda:
- <chem> Zn (s)|Zn^{2+} (1M) || Cu^{2+} (1M) | Cu (s)\,</chem>
Este diagrama sigue el orden:
- Ánodo
 Cátodo
Cátodo - electrodo negativo | electrolito || electrolito | electrodo positivo
La barra vertical "|" indica un límite entre fases (por ejemplo, entre un sólido y una solución), y la doble barra "||" representa el puente salino.
Potenciales estándar de reducción
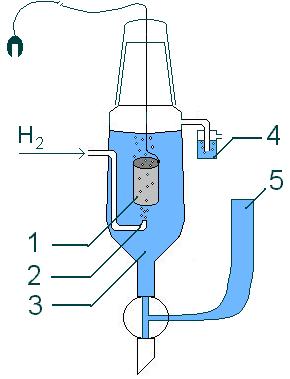
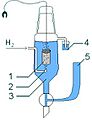
Podemos calcular el potencial estándar de reducción de una celda comparándola con un electrodo de referencia. A este electrodo de referencia, el electrodo de hidrógeno, se le asignó el valor de cero cuando está en condiciones estándar. En este electrodo ocurre la siguiente reacción:
- <chem> H2 -> 2 H^+ (aq) + 2 e^- \,</chem>
Esta reacción se realiza burbujeando gas hidrógeno en una solución de HCl, sobre un electrodo de platino. Las "condiciones estándar" significan que la presión de los gases es de 1 atm, la temperatura es de 25 °C y las concentraciones de las soluciones son de 1M. En estas condiciones:
- <chem> 2 H^+ (aq)(1 M) + 2 e^- -> H2 (1 atm)\,</chem>
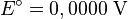
Este electrodo se llama electrodo estándar de hidrógeno (EEH). Se puede conectar a otra celda para medir su potencial de reducción.
- Si el electrodo tiene un potencial positivo, significa que se está reduciendo, y el EEH actúa como ánodo. Por ejemplo, el cobre en solución de CuSO4 tiene un potencial de 0,337 V.
- Si el electrodo tiene un potencial negativo, significa que se está oxidando, y el EEH actúa como cátodo. Por ejemplo, el zinc en solución de ZnSO4 tiene un potencial de -0,763 V.
Las reacciones son reversibles, y el papel de un electrodo depende de la relación de potenciales entre ambos. El potencial estándar de una celda se calcula restando el potencial de reducción del ánodo al del cátodo:
Por ejemplo, para el electrodo de cobre:
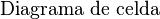
- <chem> Pt (s)| H2 (1 atm)|H^+ (1 M)|| Cu^{2+}(1 M)|Cu (s)\,</chem>
En condiciones estándar, la fem (medida con un multímetro) es 0,34 V. Como el potencial del EEH es cero, el potencial del cobre es:
El potencial de oxidación de una celda tiene el mismo valor que el de reducción, pero con signo opuesto.
Espontaneidad de una reacción redox
La relación entre el potencial de la celda (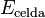 ) y la energía libre de Gibbs (
) y la energía libre de Gibbs (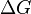 ) nos dice si una reacción ocurrirá por sí sola (será espontánea). En una celda electroquímica, la energía química se convierte en energía eléctrica. La carga eléctrica total que pasa por la celda se calcula como:
) nos dice si una reacción ocurrirá por sí sola (será espontánea). En una celda electroquímica, la energía química se convierte en energía eléctrica. La carga eléctrica total que pasa por la celda se calcula como:
Donde 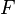 es la constante de Faraday y
es la constante de Faraday y 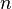 es el número de moles de electrones. La energía libre de Gibbs es la "energía disponible para hacer trabajo". Si
es el número de moles de electrones. La energía libre de Gibbs es la "energía disponible para hacer trabajo". Si 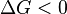 , la reacción es espontánea. Para que esto ocurra, Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): E_{\rm celda} debe ser mayor que 0. Si Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): E_{\rm celda} es negativo, la reacción no ocurrirá por sí sola.
, la reacción es espontánea. Para que esto ocurra, Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): E_{\rm celda} debe ser mayor que 0. Si Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): E_{\rm celda} es negativo, la reacción no ocurrirá por sí sola.
Una reacción espontánea puede usarse para generar energía eléctrica, como en una pila de combustible. Si una reacción no es espontánea, se le debe aplicar un potencial eléctrico para que ocurra; a esto se le llama electrólisis.
Corrosión
La corrosión es el deterioro de un material, generalmente un metal, debido a un ataque electroquímico de su entorno. Es la tendencia de los materiales a volver a una forma más estable. Cuando la corrosión es causada por una reacción electroquímica (oxidación), su velocidad depende de la temperatura, la salinidad del líquido en contacto con el metal y las propiedades del metal.
La corrosión puede ser por una reacción química (redox) influenciada por:
- El diseño de la pieza (forma, tratamiento, montaje).
- El ambiente (por ejemplo, un ambiente cerrado es menos propenso a la corrosión).
Los ejemplos más conocidos son los cambios químicos en los metales por el aire, como el herrumbre del hierro y el acero, o la capa verde que se forma en el cobre y sus aleaciones (como el bronce y el latón).
Corrosión del hierro
En el ambiente, el hierro se cubre con una capa de humedad y aire. La capa de óxido que se forma no lo protege bien, permitiendo que los iones lleguen al metal. Además, esta capa es frágil y permite que la solución electrolítica penetre. Se cree que ocurren los siguientes procesos:
- Cuando una parte de la capa metálica se rompe, actúa como ánodo, liberando electrones y permitiendo que la corrosión avance:
- <chem> Fe(s) -> Fe^{2+} (aq) + 2 e^- \,</chem>
- Los electrones se transfieren desde el hierro, reduciendo el oxígeno del aire en agua en el cátodo, en otra parte de la capa metálica:
- <chem> O2 (g) + 4 H^+ (aq) + 4 e^- -> 2 H2O (l) \,</chem>
- La reacción total es:
- <chem> 2 Fe (s) + O2 (g) + 4 H^+ (aq) -> 2 Fe^{2+} (aq) + 2 H2O (l) \,</chem>
La corrosión del hierro ocurre en un medio ácido. Los iones H+ provienen de la reacción entre el dióxido de carbono y el agua de la atmósfera, formando ácido carbónico. Los iones Fe2+ se oxidan según la siguiente ecuación:
Protección contra la corrosión
Es importante proteger los materiales, especialmente los metales, de la corrosión, ya que causa grandes pérdidas económicas. Una forma de protección son las películas protectoras, que deben ser: inertes, continuas, bien adheridas al material y capaces de repararse si se rompen.
También se pueden modificar los factores que afectan la velocidad de la corrosión (como el diseño de la pieza y el ambiente) y la propia reacción química. Además, el uso de inhibidores de la corrosión, ánodos de sacrificio y procesos como la galvanoplastia ayudan a proteger los materiales.
Aplicaciones de la electroquímica
La electroquímica tiene muchas aplicaciones importantes en la naturaleza y en la industria:
- La generación de energía química en la fotosíntesis es un proceso electroquímico.
- La producción de metales como el aluminio y el titanio se realiza mediante procesos electroquímicos.
- La galvanización (cubrir un metal con otro para protegerlo) también es una aplicación.
- Los impulsos nerviosos en las neuronas se basan en la energía eléctrica generada por el movimiento de iones de sodio y potasio dentro y fuera de las células.
- Algunos animales, como las anguilas, pueden generar una fuerte corriente eléctrica para defenderse.
Galería de imágenes
-
Esquema de la Pila de Daniell. El puente salino (representado por el tubo en forma de U invertida) contiene una disolución de KCl permitiendo la interacción eléctrica entre el ánodo y el cátodo. Las puntas de este deben estar tapadas con pedazos de algodón para evitar que la disolución de KCl contamine los otros contenedores.
Véase también
 En inglés: Electrochemistry Facts for Kids
En inglés: Electrochemistry Facts for Kids
- Electricidad
- Electrólisis
- Gradiente electroquímico
- Historia de la electricidad
- Bioelectromagnetismo
- Galvanoplastia
- Electroósmosis