Ecuación química para niños
Una ecuación química es como una receta especial que usan los científicos para describir lo que pasa en una reacción química. Imagina que quieres hacer un pastel: necesitas ingredientes y, al mezclarlos y hornearlos, obtienes el pastel. En química, los "ingredientes" se llaman reactivos y lo que se forma se llama productos.
Una ecuación química nos muestra de forma escrita, usando símbolos, qué sustancias se combinan y cuáles nuevas sustancias se forman. Así es más fácil entender y visualizar los cambios que ocurren. También nos ayuda a saber cuántos átomos o moléculas de cada sustancia participan en la reacción.
¿Sabías que la primera ecuación química de la historia fue escrita en 1615 por un científico llamado Jean Beguin en su libro Tyrocinium Chymicum?
Contenido
¿Qué necesita una ecuación química para ser correcta?
Para que una ecuación química sea válida, debe seguir algunas reglas importantes:
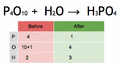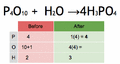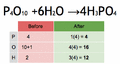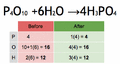
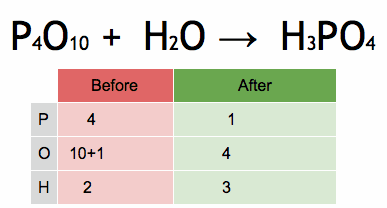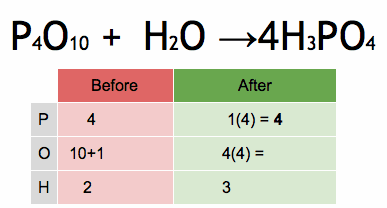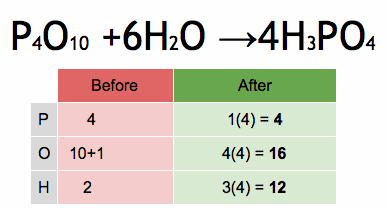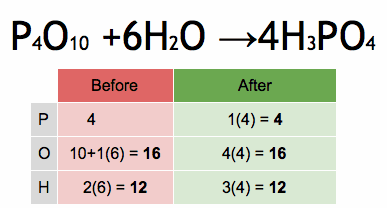
- Debe cumplir la ley de conservación de la materia. Esto significa que la cantidad de cada tipo de átomo al principio de la reacción debe ser la misma que al final. ¡Los átomos no se crean ni se destruyen, solo se reorganizan!
- Debe cumplir la ley de conservación de la carga. Si hay cargas eléctricas, la carga total debe ser la misma antes y después de la reacción.
- Debe cumplir la ley de conservación de la energía. La energía total del sistema también se mantiene constante.
Es importante saber que una ecuación química nos dice qué puede pasar, pero no siempre significa que la reacción ocurra exactamente así en la naturaleza o en un laboratorio. A veces, una reacción grande es en realidad una serie de pasos más pequeños.
Estructura de una ecuación química
Una ecuación química tiene una estructura clara:
- A la izquierda, se escriben los reactivos (las sustancias que inician la reacción).
- En el centro, hay una flecha que apunta hacia la derecha. Esta flecha significa "produce" o "reacciona para formar".
- A la derecha, se escriben los productos (las sustancias nuevas que se forman).
Cada sustancia se representa con su fórmula química. Por ejemplo, el agua es H₂O. A veces, delante de la fórmula, hay un número grande llamado coeficiente estequiométrico. Este número nos dice cuántas moléculas o unidades de esa sustancia participan en la reacción. Si no ves ningún número, significa que el coeficiente es 1. Si hay varias sustancias en un lado de la ecuación, se separan con un signo más (+).
Por ejemplo, la reacción del ácido clorhídrico con el sodio se puede escribir así: <chem>2HCl + 2Na -> 2NaCl + H2</chem> Esto se lee como: "Dos moléculas de ácido clorhídrico más dos átomos de sodio reaccionan para formar dos unidades de cloruro de sodio y una molécula de gas hidrógeno".
¿Cómo se equilibran las ecuaciones químicas?
Cuando ocurre una reacción química, los elementos no cambian. Por eso, el número de átomos de cada elemento debe ser el mismo en ambos lados de la ecuación (en los reactivos y en los productos). Lo mismo ocurre con la carga eléctrica total. Cuando una ecuación cumple estas condiciones, decimos que está equilibrada.
Para equilibrar una ecuación química, ajustamos los números grandes (los coeficientes estequiométricos) delante de cada fórmula. Las ecuaciones más sencillas se pueden equilibrar probando y ajustando los números.
A veces, se pueden usar coeficientes fraccionarios si eso simplifica la ecuación. Por ejemplo, la ecuación anterior también podría escribirse así: <chem>HCl + Na -> NaCl + 1/2 H2</chem> Esto significa que se forma media molécula de hidrógeno, lo cual es útil en algunos cálculos, aunque en la realidad las moléculas no se dividen así.
Método de inspección para equilibrar ecuaciones
Este método es como un rompecabezas. Consiste en ir ajustando los coeficientes uno por uno hasta que el número de átomos de cada elemento sea igual en ambos lados de la ecuación.
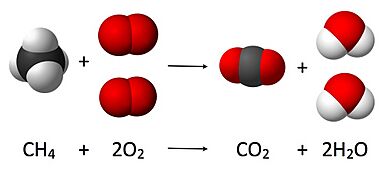
Veamos un ejemplo: la combustión del metano (el gas que usamos en casa). Queremos equilibrar esta ecuación: <chem>\mathord{?}\,{CH4} + \mathord{?}\,{O2} -> \mathord{?}\,{CO2} + \mathord{?}\,{H2O}</chem>
Aquí están los pasos:
- Empezamos por la sustancia más compleja, que es el CH₄. Le ponemos un coeficiente de 1 (aunque no se escribe):
- <chem>1 {CH4} + \mathord{?}\,{O2} -> \mathord{?}\,{CO2} + \mathord{?}\,{H2O}</chem>
- Ahora, contamos los átomos. En el lado izquierdo, tenemos 1 átomo de carbono (C) y 4 átomos de hidrógeno (H).
- Para equilibrar el carbono, necesitamos 1 molécula de CO₂ en el lado derecho.
- Para equilibrar el hidrógeno, como cada molécula de H₂O tiene 2 átomos de hidrógeno, necesitamos 2 moléculas de agua (2 x 2 = 4 átomos de H).
- <chem>1 {CH4} + \mathord{?}\,{O2} -> 1 {CO2} + 2 H2O</chem>
- Finalmente, equilibramos el oxígeno (O). En el lado derecho, tenemos 2 átomos de oxígeno en el CO₂ y 2 átomos de oxígeno en las 2 moléculas de H₂O (1x2=2), lo que suma un total de 4 átomos de oxígeno. Para tener 4 átomos de oxígeno en el lado izquierdo, necesitamos 2 moléculas de O₂ (2 x 2 = 4 átomos de O).
- <chem>1 CH4 + 2 O2 -> 1 CO2 + 2 H2O</chem>
- Como los coeficientes de 1 no se escriben, la ecuación equilibrada final es:
- <chem>CH4 + 2 O2 -> CO2 + 2 H2O</chem>
- Siempre es bueno revisar al final:
- Carbono (C): 1 en reactivos, 1 en productos. ¡Correcto!
- Hidrógeno (H): 4 en reactivos, 4 en productos. ¡Correcto!
- Oxígeno (O): 4 en reactivos, 4 en productos. ¡Correcto!
Método de sistema de ecuaciones lineales
Para ecuaciones más complicadas, los científicos pueden usar un método matemático que implica resolver un sistema de ecuaciones. Cada elemento en la ecuación se convierte en una pequeña ecuación matemática. Al resolver este sistema, se encuentran los coeficientes correctos para equilibrar la ecuación.
Por ejemplo, para la combustión del metano: <chem>\mathit{s}_1 {CH4} + \mathit{s}_2 {O2} -> \mathit{s}_3 {CO2} + \mathit{s}_4 {H2O}</chem> Se crean ecuaciones para cada elemento:
- Carbono (C): s₁ = s₃
- Hidrógeno (H): 4s₁ = 2s₄
- Oxígeno (O): 2s₂ = 2s₃ + s₄
Al resolver estas ecuaciones, se obtienen los valores de s₁, s₂, s₃ y s₄ que equilibran la ecuación, como s₁=1, s₂=2, s₃=1, s₄=2, lo que nos da la misma ecuación equilibrada: <chem>CH4 + 2 O2 -> CO2 + 2 H2O</chem>
Catálisis y otras condiciones especiales
A veces, una reacción química necesita condiciones especiales para ocurrir. Estas condiciones se indican encima o debajo de la flecha de la ecuación:
- Si se necesita calor, se usa un triángulo (△) o la letra griega delta (Δ).
- Si se necesita luz, se usa la expresión hν.
- Si la reacción necesita un ambiente ácido o básico, se puede escribir H⁺ o OH⁻ (o "ácido" o "base") sobre la flecha.
- También se pueden indicar la temperatura, la presión o la presencia de un catalizador. Un catalizador es una sustancia que acelera una reacción sin consumirse en ella.
Galería de imágenes
Véase también
 En inglés: Chemical equation Facts for Kids
En inglés: Chemical equation Facts for Kids