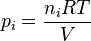Ley de las presiones parciales para niños
La Ley de las Presiones Parciales, también conocida como Ley de Dalton, es una regla muy importante en el mundo de la química y la física. Fue descubierta en 1802 por el científico británico John Dalton. Esta ley nos dice que si tienes una mezcla de gases que no reaccionan entre sí, la presión total de esa mezcla es igual a la suma de las presiones que cada gas ejercería si estuviera solo en el mismo recipiente y a la misma temperatura.
Imagina que tienes una caja llena de diferentes tipos de pelotas que rebotan. La presión total en la caja es como la fuerza combinada de todas las pelotas chocando contra las paredes. La Ley de Dalton nos ayuda a entender cómo cada tipo de pelota (o gas) contribuye a esa fuerza total.
Contenido
¿Qué es la Ley de Dalton?
La Ley de Dalton establece que la presión total de una mezcla de gases es la suma de las presiones parciales de cada uno de los gases que la componen. Esto solo funciona si los gases no se combinan químicamente entre sí. Por ejemplo, los gases nobles (como el helio o el neón) son perfectos para esto, ya que no suelen reaccionar.
La idea principal se puede resumir así:
|
Esto se puede escribir con una fórmula sencilla:
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): p_{total} = p_1 + p_2 + ... + p_n
Donde Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): p_{total} es la presión total de la mezcla, y 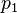 ,
, 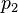 , etc., son las presiones parciales de cada gas individual en la mezcla.
, etc., son las presiones parciales de cada gas individual en la mezcla.
¿Quién fue John Dalton?
John Dalton fue un científico muy importante que vivió en el Reino Unido hace mucho tiempo. Nació en 1766 y falleció en 1844. Fue un físico, químico y matemático que hizo muchos descubrimientos. Además de la Ley de las Presiones Parciales, es famoso por su teoría atómica, que fue un gran avance para entender cómo está hecha la materia. Sus ideas ayudaron a sentar las bases de la química moderna.
Entendiendo la Presión Parcial
Cuando Dalton empezó a estudiar los gases, se dio cuenta de que cuando mezclaba dos gases, estos actuaban de forma independiente. Es como si cada gas no se diera cuenta de que el otro está ahí.
Imagina que tienes un recipiente con un cierto volumen. Si pones tres gases diferentes en ese recipiente, cada uno de esos gases ocupará todo el espacio disponible. Es decir, cada gas se expandirá para llenar el recipiente completo y tendrá la misma temperatura que los demás.
La presión que cada gas ejerce por sí mismo en la mezcla se llama presión parcial. Esta presión depende de cuántas moléculas de ese gas hay y de la fuerza con la que esas moléculas chocan contra las paredes del recipiente. Como todos los gases están en el mismo volumen y a la misma temperatura, las diferencias en sus presiones parciales se deben a la cantidad de cada gas presente.
¿Cómo se calcula la presión parcial?
Para calcular la presión parcial de un gas en una mezcla, los científicos usan la ley de los gases ideales. Esta ley nos ayuda a entender cómo se comportan los gases en diferentes condiciones. La fórmula para la presión parcial (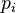 ) de un gas es:
) de un gas es:
Aquí, 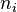 es la cantidad de ese gas (medida en moles),
es la cantidad de ese gas (medida en moles), 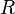 es una constante universal de los gases ideales (un número fijo),
es una constante universal de los gases ideales (un número fijo), 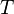 es la temperatura, y
es la temperatura, y 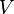 es el volumen del recipiente.
es el volumen del recipiente.
En resumen, la Ley de Dalton es una herramienta muy útil para entender cómo se comportan las mezclas de gases, como el aire que respiramos, que es una mezcla de muchos gases diferentes.
Véase también
 En inglés: Dalton's law Facts for Kids
En inglés: Dalton's law Facts for Kids
de:Partialdruck#Dalton-Gesetz