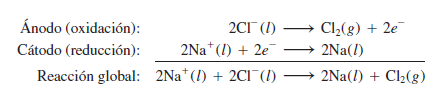Electrólisis para niños
La electrólisis es un proceso muy interesante que usa la electricidad para separar los elementos que forman un compuesto. Imagina que tienes agua (H₂O), que está hecha de hidrógeno y oxígeno. Con la electrólisis, puedes usar una corriente eléctrica para dividir el agua y obtener hidrógeno por un lado y oxígeno por otro.
Este proceso ocurre en unos aparatos especiales llamados celdas electrolíticas. En estas celdas, la electricidad ayuda a que sucedan reacciones químicas que normalmente no pasarían por sí solas. Es como si la electricidad diera la energía necesaria para "desarmar" el compuesto.
La electrólisis es lo contrario de lo que pasa en una celda galvánica (como una batería). Una batería produce electricidad a partir de reacciones químicas, mientras que la electrólisis usa electricidad para provocar reacciones químicas.
Contenido
Historia de la electrólisis
La electrólisis fue descubierta por accidente en el año 1800 por un científico llamado William Nicholson. Él estaba investigando cómo funcionaban las baterías de la época.
En 1834, el famoso físico y químico inglés Michael Faraday estudió a fondo este proceso. Él fue quien creó el nombre "electrólisis" y también formuló las leyes que explican cómo funciona.
Primeros experimentos
A principios del siglo XIX, William Nicholson y Anthony Carlisle quisieron entender mejor los experimentos de Alessandro Volta, quien había inventado la pila. Conectaron dos cables a una pila y metieron los otros extremos en un tubo con agua. Se dieron cuenta de que, al juntar los cables, salían burbujas de cada uno. ¡Eran burbujas de hidrógeno y oxígeno! Así descubrieron cómo separar el agua.
Antes de ellos, en 1785, un científico neerlandés llamado Martin van Marum usó un generador eléctrico para obtener metales como el estaño, el zinc y el antimonio de sus sales. Aunque no sabía que estaba haciendo electrólisis, sus experimentos fueron un paso importante.
En 1791, Luigi Galvani hizo experimentos con ancas de rana y pensó que el músculo animal producía electricidad. Alessandro Volta investigó esto y sus ideas ayudaron a Humphry Davy a entender mejor la electrólisis. Davy pensó que al combinar dos elementos, se liberaba energía eléctrica. Él creó unas "Tablas de Descomposición" que mostraban la energía necesaria para separar ciertos compuestos.
Descubrimiento de elementos
La electrólisis ha sido clave para descubrir y aislar muchos elementos químicos.
- En 1817, Johan August Arfwedson encontró litio en algunas de sus muestras, pero no pudo separarlo. Fue William Thomas Brande quien, en 1821, usó la electrólisis para obtener litio puro.
- En 1875, Paul Émile Lecoq de Boisbaudran descubrió el galio usando electrólisis con hidróxido de galio.
- En 1886, Ferdinand Frederick Henri Moissan logró obtener flúor gaseoso puro mediante la electrólisis de fluoruro de hidrógeno. Este fue un proceso muy difícil y peligroso en su época.
La electrólisis y el aluminio
En 1886, dos científicos, Charles Martin Hall en Estados Unidos y Paul Héroult en Francia, desarrollaron casi al mismo tiempo un método para producir aluminio usando electrólisis. Este método, conocido como el proceso Hall-Héroult, fue muy importante porque hizo que el precio del aluminio bajara mucho, beneficiando a muchas industrias.
¿De dónde viene la palabra "electrólisis"?
La palabra "electrólisis" fue creada por Michael Faraday en 1834. Viene de dos palabras griegas:
- Elektron: que significa "ámbar". Desde el siglo XVII, el ámbar se asociaba con los fenómenos eléctricos.
- Lysis: que significa "disolución" o "separación".
Así que, electrólisis significa "separación por medio de la electricidad".
¿Cómo funciona la electrólisis?
Para hacer electrólisis, necesitas:
- Una fuente de corriente continua (como una batería).
- Dos electrodos (piezas que conducen la electricidad).
- Una disolución (un líquido que contiene iones, es decir, átomos o moléculas con carga eléctrica).
Así es como sucede el proceso:
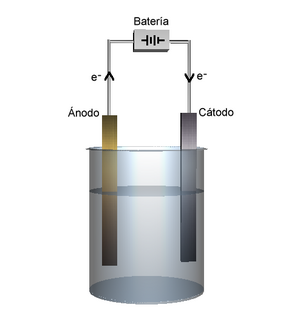
- Los electrodos se conectan a la fuente de electricidad y se sumergen en la disolución.
- El electrodo conectado al polo negativo de la batería se llama cátodo.
- El electrodo conectado al polo positivo se llama ánodo.
- En la disolución, hay iones: algunos tienen carga positiva (llamados cationes) y otros tienen carga negativa (llamados aniones).
- Los iones negativos (aniones) son atraídos hacia el ánodo (el electrodo positivo). Allí, ceden electrones.
- Los iones positivos (cationes) son atraídos hacia el cátodo (el electrodo negativo). Allí, toman electrones.
- Esta transferencia de electrones en los electrodos hace que se formen nuevas sustancias.
En resumen, la electrólisis es una reacción química donde la electricidad es la que aporta la energía necesaria para que todo ocurra.
Consejos para recordar los nombres
- Electrodo: Es el "camino" por donde van los electrones.
- Cátodo: Es el "camino" por donde los electrones "caen" o son tomados por los iones.
- Ánodo: Es el "camino" por donde los electrones "ascienden" o son cedidos por los iones.
- Ion: Significa "caminante". Los aniones van al ánodo y los cationes van al cátodo.
- En el ánodo ocurre la oxidación (ambas palabras empiezan con vocal).
- En el cátodo ocurre la reducción (ambas palabras empiezan con consonante).
Obtención de sustancias por electrólisis
Electrólisis del agua
Cuando se hace electrólisis del agua, se separan el oxígeno y el hidrógeno. Es importante saber que el agua pura no conduce bien la electricidad. Lo que hace que el agua conduzca son los minerales y sales disueltas en ella.
Algunas cosas importantes a tener en cuenta:
- Nunca juntes los electrodos, porque la batería podría sobrecalentarse.
- Siempre usa corriente continua (de baterías o adaptadores), nunca corriente alterna (la de los enchufes de casa).
- Los gases de hidrógeno y oxígeno que se producen deben mantenerse separados, porque si se mezclan en ciertas proporciones, pueden formar una mezcla explosiva.
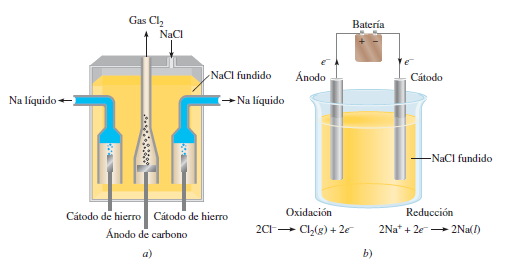
Electrólisis del cloruro de sodio fundido
El cloruro de sodio (sal de mesa) se puede fundir a muy alta temperatura. Cuando está fundido, se puede usar electrólisis para obtener sodio metálico y gas cloro. En el cloruro de sodio fundido, hay iones de sodio (Na⁺) y de cloro (Cl⁻).
- En el cátodo (negativo), los iones de sodio (Na⁺) toman electrones y se convierten en sodio metálico.
- En el ánodo (positivo), los iones de cloro (Cl⁻) ceden electrones y se convierten en gas cloro (Cl₂).
Este proceso es muy importante para obtener sodio metálico puro y gas cloro, que se usan en muchas industrias. Se necesita mucha energía eléctrica para que esta reacción ocurra.
Usos importantes de la electrólisis
La electrólisis tiene muchísimas aplicaciones en la industria y en nuestra vida diaria:
- Se usa para producir metales como el aluminio, sodio, potasio y magnesio.
- Ayuda a fabricar sustancias químicas importantes como el hidróxido de sodio (sosa cáustica), ácido clorhídrico y clorato de sodio.
- Produce hidrógeno, que se usa como combustible o en soldaduras.
- La electrólisis de agua con sal se usa para producir hipoclorito (lejía), que sirve para desinfectar el agua de las piscinas de forma más amigable con el ambiente.
- La electrometalurgia es un proceso que usa electrólisis para obtener metales muy puros de sus compuestos.
- La anodización es una técnica que usa electrólisis para proteger los metales de la corrosión (cuando se oxidan o se "oxidan").
- La galvanoplastia es otro uso para proteger metales. Consiste en cubrir un metal con una capa delgada de otro metal que se corroe menos, como cuando se "cromado" un objeto.
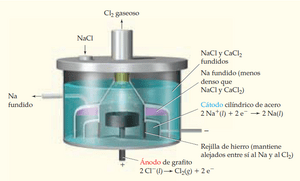
Fabricación de sodio
El sodio metálico se produce en grandes fábricas usando unas celdas especiales llamadas celdas Downs. En estas celdas, se electroliza una mezcla fundida de cloruro de sodio y cloruro de calcio. El cloruro de calcio ayuda a que la mezcla se funda a una temperatura más baja, lo que ahorra energía. El sodio líquido que se forma flota y se recolecta, mientras que el gas cloro se forma en otra parte de la celda.
Estas plantas suelen estar cerca de fuentes de energía eléctrica barata, como las Cataratas del Niágara en Nueva York, porque el proceso necesita mucha electricidad.
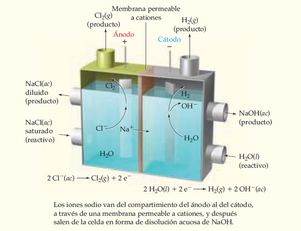
Fabricación de cloro e hidróxido de sodio
La producción de cloro e hidróxido de sodio a partir de sal (cloruro de sodio) es una industria enorme.
- El cloro se usa para purificar el agua, blanquear papel y fabricar plásticos como el PVC.
- El hidróxido de sodio se usa para hacer papel, textiles, jabones y detergentes.
Para esto, se usan celdas de membrana. Una disolución de sal entra en un compartimento, donde el cloro se produce en el ánodo. En otro compartimento, el agua se convierte en hidrógeno y iones hidróxido en el cátodo. Una membrana especial entre los compartimentos permite que los iones de sodio pasen, pero mantiene separados el cloro y los iones hidróxido, asegurando que se obtengan los productos deseados.
.
Véase también
 En inglés: Electrolysis Facts for Kids
En inglés: Electrolysis Facts for Kids