Torio para niños
Datos para niños Actinio ← Torio → Protactinio |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Torio, Th, 90 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Actínidos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | -, 7, f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 232,0381 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Rn] 6d2 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Mohs | 3,0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 32, 18, 10, 2 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Blanco plateado | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 180 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,3 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 179 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 206±6 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 4, 3, 2 (base débil) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 587 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 1 110 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª energía de ionización | 193 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª energía de ionización | 2 780 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 11 724 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 2028 K (1755 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 5061 K (4788 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 514,4 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 16,1 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Cúbica centrada en las caras | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 120 J/(kg·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | 6,53 × 106 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 54 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo elástico | 79 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coeficiente de Poisson | 0,27 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 2 490 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del torio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El torio es un elemento químico con el símbolo Th y el número atómico 90. Pertenece a la familia de los actínidos en la tabla periódica. Se encuentra de forma natural en minerales como la monacita, la torita y la torianita. Cuando está puro, el torio es un metal blando de color blanco plateado. Se oxida lentamente al contacto con el aire. Si se tritura muy fino y se calienta, puede arder y emitir una luz blanca brillante.
El torio es un elemento que se transforma con el tiempo, liberando energía. Su isótopo más común, el torio-232, tarda muchísimo tiempo en transformarse. Los científicos están investigando el torio como un posible combustible nuclear. Esto se debe a que puede convertirse en uranio-233, un isótopo que puede usarse para generar energía en reactores nucleares. Esta aplicación aún se está desarrollando.
El torio fue descubierto en 1828 por el aficionado a los minerales noruego Morten Thrane Esmark. Fue identificado por el químico sueco Jöns Jacob Berzelius, quien lo nombró en honor a Thor, el dios del trueno de la mitología nórdica. A finales del siglo XIX, se empezaron a encontrar usos para el torio. Durante las primeras décadas del siglo XX, se reconoció ampliamente su capacidad de transformarse. Sin embargo, en la segunda mitad del siglo, el torio fue reemplazado en muchos de sus usos debido a preocupaciones sobre sus propiedades.
Hoy en día, el torio se usa a veces en los electrodos para soldadura TIG, aunque se está buscando reemplazarlo. También se usó en lentes de alta calidad y en algunos tubos de vacío. Además, fue una fuente de luz en las camisas de gas (una especie de bombillas antiguas). Se ha propuesto como una alternativa al uranio para generar energía en reactores nucleares, y ya se han construido algunos reactores que usan torio. Este elemento también se utiliza para hacer más fuerte el magnesio, para cubrir los hilos de tungsteno en equipos eléctricos y para controlar el tamaño de grano del tungsteno en bombillas. También se usa en crisoles (recipientes para altas temperaturas) y en algunos tipos de vidrio, como lentes de cámaras. Otros usos incluyen cerámicas que resisten el calor y componentes para motores de aviones. En la ciencia del océano, se usan proporciones de isótopos de torio para estudiar cómo era el océano en el pasado.
Contenido
Historia del Torio
El nombre "torio" viene de Thor, el dios nórdico del rayo y la tormenta. El químico Jöns Jakob Berzelius fue el primero en aislarlo en 1828. A finales del siglo XIX, los famosos investigadores Pierre Curie y Marie Curie descubrieron que este elemento liberaba energía.
¿Dónde se encuentra el Torio?
Cómo se forma el Torio
El isótopo torio-232 (232Th) es un elemento primordial. Esto significa que ha existido en su forma actual por más de diez mil millones de años. Se formó durante un proceso llamado "proceso r", que ocurre en eventos cósmicos muy violentos como las supernovas (explosiones de estrellas) y las kilonovas (cuando se fusionan estrellas de neutrones). Estos eventos esparcieron el torio por toda la galaxia.
El proceso r es la única forma en que las estrellas pueden crear elementos más pesados que el hierro. Esto se debe a que los núcleos de los átomos capturan neutrones muy rápido. Es la única manera de formar torio y uranio, ya que otros procesos son demasiado lentos.
En el universo, el torio es uno de los elementos primordiales más escasos. Esto es porque solo se puede producir en el proceso r y porque se ha ido transformando lentamente desde que se formó.
El Torio en la Tierra
En la corteza terrestre, el torio es más abundante. Es el elemento número 41 más común, casi tan abundante como el plomo. Esto se debe a que el torio tiende a formar minerales de óxido que no se hunden hacia el centro de la Tierra. Por eso, hay más torio disponible en la corteza que otros metales pesados.
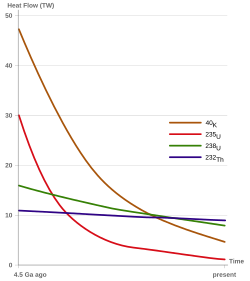
El torio natural es casi todo torio-232 (232Th). Este es el isótopo de torio más duradero y estable. Su transformación lenta contribuye mucho al calor interno de la Tierra. Otros elementos que también aportan calor son el uranio-238, el potasio-40 y el uranio-235.
El torio solo se encuentra en pequeñas cantidades en la mayoría de los minerales. Por eso, antes se pensaba que era un elemento raro. El suelo suele contener unas 6 partes por millón (ppm) de torio.
En la naturaleza, el torio se encuentra en un estado químico llamado +4. Se asocia con otros elementos como el uranio, el zirconio y el cerio. Debido a que el torio se transforma, los minerales que lo contienen a menudo tienen sus estructuras cristalinas dañadas. Un ejemplo es la ekanita, un mineral que casi nunca se encuentra sin daños por la transformación del torio.
La monacita es la fuente más importante de torio para la industria. Se encuentra en grandes depósitos en países como India, Sudáfrica, Brasil, Australia y Malasia. Contiene alrededor del 2.5% de torio, aunque algunos depósitos pueden tener hasta un 20%. La monacita es una arena amarilla o marrón que no reacciona fácilmente, lo que hace difícil extraer el torio de ella. Otros minerales como la alanita y el zirconio también pueden contener torio.
El dióxido de torio se encuentra como un mineral raro llamado torianita. La torita (silicato de torio) también tiene mucho torio y fue el mineral donde se descubrió por primera vez. Como el dióxido de torio no se disuelve fácilmente en agua, el torio no se esparce rápidamente por el ambiente si se libera. Sin embargo, en suelos ácidos, el torio puede disolverse y alcanzar concentraciones de hasta 40 ppm.
Usos del Torio
Además de su uso potencial como combustible nuclear, el torio o sus óxidos se utilizan en varias áreas:
- Se añade al wolframio para fabricar los filamentos de las bombillas.
- Se usa en material cerámico que soporta altas temperaturas.
- Como:
- Agente para crear aleaciones en estructuras metálicas.
- Componente clave en la tecnología del magnesio.
- Catalizador en química orgánica (ayuda a que las reacciones químicas ocurran más rápido).
- Fabricación de:
- Lámparas electrónicas.
- Lentes de alta calidad para instrumentos de precisión. El óxido de torio mejora las propiedades de la luz en el vidrio.
- Electrodos especiales para soldadura TIG. Al mezclarlo con wolframio, el electrodo funciona mejor a menor temperatura. Esto evita que el electrodo se dañe por el calor.
- Detector de oxígeno en la industria electrónica.
- Recientemente (2018), se usa un isótopo de torio para datar fósiles, siendo más preciso que el carbono 14.
El isótopo torio-229 también se utiliza en la fabricación de relojes atómicos, que son muy precisos.
Transformación del Torio
Cuando un átomo de torio-232 (232Th) se transforma, emite una partícula alfa. Esta partícula está formada por dos protones y dos neutrones. Al emitir esta partícula, el torio-232 se convierte en radio-228. Luego, el radio-228 y otros elementos siguen transformándose en una serie, hasta que finalmente se forma un elemento estable que no se transforma más: el plomo-208.
El torio-232 tarda muchísimo tiempo en transformarse (miles de millones de años). Esto significa que, aunque se transforma, la cantidad de energía que libera en un corto periodo de tiempo es muy pequeña.
El torio puede usarse como fuente de energía en un reactor especial. En este reactor, el torio se convierte en uranio-233, que luego se usa para producir energía.
Galería de imágenes
Véase también
 En inglés: Thorium Facts for Kids
En inglés: Thorium Facts for Kids