Roentgenio para niños
Datos para niños Darmstatio ← Roentgenio → Copernicio |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Roentgenio, Rg, 111 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Metales de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 01, 9 sí me 7i, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 282 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Rn] 5f14 6d9 7s2 (predicción) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
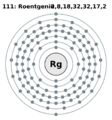
| Electrones por nivel | 2, 8, 18, 32, 32, 17, 2 (predicción) (imagen) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Desconocida, probablemente líquido gris | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 121 (estimado) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | −1, +1, +3, +5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Desconocido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del roentgenio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El roentgenio es un elemento químico muy especial que se encuentra en la Tabla periódica de los elementos. Su símbolo es Rg y su número atómico es 111. Esto significa que cada átomo de roentgenio tiene 111 protones en su núcleo.
Contenido
¿Cómo se descubrió el Roentgenio?
Este elemento fue creado por primera vez en un laboratorio en 1994. Un grupo de científicos alemanes lo logró en la ciudad de Darmstadt.
En noviembre de 2004, el roentgenio recibió su nombre en honor a Wilhelm Conrad Röntgen. Él fue un científico muy importante que ganó el Premio Nobel de Física por descubrir los rayos X.
Para crear roentgenio, los científicos bombardearon láminas de bismuto (Bi) con iones de níquel (Ni). El roentgenio que se forma es muy inestable y se descompone rápidamente, en solo 15 milisegundos.
Isótopos del Roentgenio
Los isótopos son versiones de un mismo elemento que tienen diferente número de neutrones. El roentgenio no tiene isótopos que existan de forma natural o que sean estables. Todos sus isótopos son creados en laboratorios y son radiactivos.
Se han logrado crear nueve isótopos diferentes de roentgenio. Sus masas atómicas van desde 272 hasta 286. Estos isótopos se desintegran, es decir, se transforman en otros elementos, principalmente a través de un proceso llamado desintegración alfa o por fisión espontánea.
¿Qué tan estables son los isótopos de Roentgenio?
Todos los isótopos de roentgenio son muy inestables y radiactivos. Esto significa que se desintegran muy rápido. Generalmente, los isótopos más pesados son un poco más estables que los más ligeros.
El isótopo de roentgenio más estable que conocemos es el roentgenio-282. Tiene una vida media de 100 segundos. Esto significa que, en 100 segundos, la mitad de una muestra de roentgenio-282 se habrá desintegrado.
También se ha hablado de un isótopo llamado roentgenio-286, que podría tener una vida media de unos 10.7 minutos. Si esto se confirma, sería uno de los elementos superpesados más duraderos conocidos.
Propiedades del Roentgenio
Como el roentgenio se produce en cantidades muy pequeñas y se descompone tan rápido, es muy difícil estudiar sus propiedades. Por eso, muchas de sus características se basan en predicciones y cálculos científicos.
¿Cómo se comporta químicamente el Roentgenio?
El roentgenio pertenece al grupo 11 de la tabla periódica, junto con el cobre, la plata y el oro. Se espera que sus propiedades químicas sean parecidas a las del oro.
Se cree que el roentgenio es un metal noble, lo que significa que no reacciona fácilmente con otros elementos. Se predice que su estado de oxidación más común será +3, similar al oro.
Los científicos también creen que el roentgenio podría formar compuestos complejos, como el Rg(CN)−
2, de manera similar a cómo el oro forma el Au(CN)−
2 en el proceso de extracción de oro.
¿Cómo es el Roentgenio físicamente?
Se espera que el roentgenio sea un sólido a temperatura ambiente. También se cree que será un metal muy pesado, con una densidad de entre 22 y 24 gramos por centímetro cúbico. Para que te hagas una idea, el osmio, que es el elemento más denso conocido, tiene una densidad de 22.61 gramos por centímetro cúbico.
A diferencia del cobre, la plata y el oro, que tienen colores distintivos, se predice que el roentgenio tendrá una apariencia plateada. Su radio atómico se estima en unos 138 picómetros.
Galería de imágenes
Véase también
 En inglés: Roentgenium Facts for Kids
En inglés: Roentgenium Facts for Kids