Relación de indeterminación de Heisenberg para niños
En el mundo de la mecánica cuántica, el Principio de Incertidumbre de Heisenberg es una idea muy importante. Fue propuesto por el físico alemán Werner Heisenberg en 1927. Este principio nos dice que no podemos conocer con total precisión, al mismo tiempo, ciertos pares de características de una partícula. Por ejemplo, no podemos saber con exactitud la posición y el movimiento (o momento lineal) de una partícula al mismo tiempo.
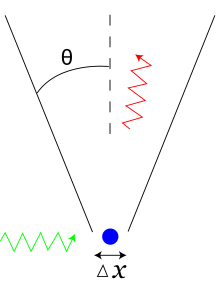
Imagina que quieres saber dónde está un objeto y hacia dónde se mueve. Si intentas saber su posición con mucha exactitud, entonces sabrás menos sobre su movimiento. Y si sabes mucho sobre su movimiento, sabrás menos sobre su posición. Este principio no es un problema de nuestros instrumentos de medida, sino una característica fundamental de cómo se comportan las partículas muy pequeñas.
Contenido
¿Qué es el Principio de Incertidumbre de Heisenberg?
El Principio de Incertidumbre de Heisenberg nos enseña que hay un límite en la precisión con la que podemos conocer ciertas propiedades de las partículas subatómicas. Estas propiedades son como la posición (dónde está algo) y el momento lineal (qué tan rápido se mueve y en qué dirección).
¿Por qué es "incierto" el mundo cuántico?
A veces, se piensa que esta "incertidumbre" ocurre porque al intentar medir algo, lo perturbamos. Por ejemplo, si quieres ver un electrón, necesitas que algo (como un fotón de luz) choque con él. Ese choque cambia la posición y la velocidad del electrón.
Sin embargo, el principio va más allá de un simple problema de medición. Lo que realmente nos dice es que las partículas muy pequeñas, como los electrones, no tienen una posición y un momento lineal definidos al mismo tiempo, como lo hacen los objetos grandes en nuestra vida diaria. Es como si existieran en varios lugares y con varios movimientos a la vez, hasta que los observamos.
Este principio marca una gran diferencia entre la física clásica (que describe el mundo grande que vemos) y la mecánica cuántica (que describe el mundo muy pequeño). En la física clásica, pensamos que podemos conocer todo sobre un objeto con la precisión que queramos. Pero en el mundo cuántico, esto no es posible.
¿Es el principio de incertidumbre contrario a nuestra intuición?
Sí, este principio puede parecer extraño al principio. Estamos acostumbrados a pensar que si conocemos dónde está un objeto y cómo se mueve en un momento dado, podemos predecir dónde estará y cómo se moverá en el futuro. Esto es lo que nos enseña la física clásica.
Pero en la mecánica cuántica, la idea de que una partícula sigue una trayectoria exacta no funciona. No podemos preguntar dónde está una partícula y cómo se mueve exactamente al mismo tiempo, porque esas dos cosas no tienen un valor preciso a la vez. El Principio de Incertidumbre nos muestra que si intentamos usar las ideas de la física clásica para describir el movimiento de las partículas cuánticas, hay un límite fundamental en la precisión con la que podemos hacerlo.
Consecuencias del Principio de Incertidumbre
Este principio cambió la forma en que los científicos entienden el universo. Pasamos de un conocimiento que se creía totalmente preciso a uno basado en probabilidades. Aunque en nuestro mundo cotidiano, la incertidumbre cuántica es tan pequeña que no la notamos, es crucial para entender el comportamiento de las partículas más diminutas.
Las partículas en la mecánica cuántica no siguen caminos definidos. En lugar de saber exactamente dónde estará una partícula, solo podemos calcular la probabilidad de que se encuentre en una cierta región del espacio en un momento dado.
Algunos fenómenos interesantes que se relacionan con el Principio de Incertidumbre de Heisenberg son:
- El Efecto túnel: Cuando una partícula puede "atravesar" una barrera, incluso si no tiene suficiente energía para hacerlo.
- La Energía del punto cero: Incluso a la temperatura más baja posible, las partículas aún tienen un poco de energía.
- La existencia de partículas virtuales: Partículas que aparecen y desaparecen muy rápidamente.
- La Energía del vacío: El espacio vacío no está realmente vacío, sino que tiene energía.
- La Radiación de Hawking: Un tipo de radiación que se cree que emiten los agujeros negros.
Expresión matemática del Principio de Incertidumbre
El Principio de Incertidumbre se puede escribir con una fórmula matemática. Si medimos la posición (Δx) y el momento lineal (Δp) de una partícula, la multiplicación de sus incertidumbres siempre será mayor o igual que un valor muy pequeño:
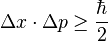
Aquí, la letra griega "hbarra" (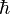 ) es la constante de Planck dividida por 2π. La constante de Planck es un número extremadamente pequeño: Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): h =\,\, 6,626\ 0693 (11) \times10^{-34}\ \mbox{J}\cdot\mbox{s}
) es la constante de Planck dividida por 2π. La constante de Planck es un número extremadamente pequeño: Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): h =\,\, 6,626\ 0693 (11) \times10^{-34}\ \mbox{J}\cdot\mbox{s}
Debido a que la constante de Planck es tan pequeña, esta incertidumbre solo es notable en el mundo de las partículas subatómicas. Para objetos grandes, como una pelota de fútbol, la incertidumbre es tan insignificante que no la notamos.
También existe una relación similar para la energía (ΔE) y el tiempo (Δτ):
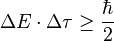
Esta relación es útil para entender cómo se forman y desaparecen las partículas virtuales en periodos de tiempo muy cortos.
Galería de imágenes
Véase también
 En inglés: Uncertainty principle Facts for Kids
En inglés: Uncertainty principle Facts for Kids