Oro para niños
Datos para niños Platino ← Oro → Mercurio |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Oro, Au, 79 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Metales de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 11, 6, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 196,966569(4) u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Xe] 4f14 5d10 6s1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Mohs | 3,0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 32, 18, 1 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Amarillo metálico | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 135 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 2,54 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 173 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 144 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de van der Waals | 166 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 3, 1 (anfótero) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 890,1 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 1980 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 19 300 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 1337,33 K (1064 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 3129 K (2856 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 3,097 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 12,55 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 0,000237 Pa a 1337 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | cúbica centrada en las caras | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 128 J/(kg·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | 4,5 × 107 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 317 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 1.740 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del oro | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El oro es un elemento químico con el número atómico 79. Se encuentra en el grupo 11 de la tabla periódica. Es un metal precioso de color amarillo dorado y es bastante blando. Su símbolo es Au, que viene del latín aurum, que significa ‘brillante amanecer’.
El oro es muy valorado en joyería por sus propiedades especiales. Es un metal que no se altera fácilmente, es muy maleable (se puede estirar en láminas finas), dúctil (se puede convertir en hilos) y brillante. También es apreciado por ser raro y difícil de encontrar en la naturaleza.
Este metal de transición es blando, brillante, amarillo y pesado. El oro no reacciona con la mayoría de los productos químicos. Sin embargo, sí puede disolverse en algunas sustancias como el cianuro, el mercurio, el agua regia, el cloro y la lejía.
El oro se encuentra en la naturaleza en estado puro, a veces como pepitas o en depósitos de ríos. Se cree que este elemento se formó en el espacio. Se crea en las condiciones extremas del centro de las supernovas (estrellas muy grandes que explotan). Cuando una estrella explota, sus capas exteriores se comprimen. Esto calienta la materia y hace que elementos más ligeros, como el hierro, se unan para formar metales más pesados, como el oro. Un estudio reciente sugiere que el oro de nuestro planeta llegó de la colisión de estrellas de neutrones.
Los depósitos de oro en la corteza terrestre se forman a partir de gases y líquidos muy calientes. Estos suben desde el interior de la Tierra a través de grietas en la corteza.
En heráldica (el estudio de los escudos y símbolos), el oro representa el poder económico y la vanidad.
Contenido
Propiedades del Oro

El oro tiene un color amarillo brillante. Es el metal más maleable y dúctil que se conoce. Esto significa que una pequeña cantidad de oro, como una onza troy (aproximadamente 31,10 g), puede estirarse hasta formar una lámina muy fina que cubra un área de 28 metros cuadrados. Como es un metal blando, a menudo se mezcla con otros metales para hacerlo más duro.
Además, el oro es un buen conductor del calor y de la electricidad. No se daña fácilmente con el aire, la humedad o la mayoría de los agentes corrosivos. Por eso, es ideal para hacer monedas y joyas, ya que mantiene su brillo y forma por mucho tiempo.
Es un metal muy denso, con un punto de fusión alto. Sus estados de oxidación más comunes son 1+ y 3+. Esto se refiere a cómo se comporta el oro al formar compuestos con otros elementos.
¿Cómo reacciona el oro con otras sustancias?
El oro es un metal muy poco reactivo. No se altera con el aire, el calor o la humedad. Sin embargo, puede disolverse en mezclas que contienen cloruros, bromuros o yoduro. También se disuelve en otras mezclas que lo oxidan, en cianuros alcalinos y en agua regia. El agua regia es una mezcla especial de ácido nítrico y ácido clorhídrico.
Cuando el oro se disuelve en agua regia, se forma ácido cloroáurico. Este ácido se puede convertir de nuevo en oro metal usando disulfito de sodio. El oro también se vuelve soluble si se expone al cianuro.
Isótopos del Oro
El oro tiene solo un isótopo natural y estable, llamado 197Au. Además de este, los científicos han creado 36 radioisótopos diferentes en laboratorios. Estos radioisótopos tienen masas atómicas que van desde 169 hasta 205.
El radioisótopo más estable es el 195Au, que tiene una periodo de semidesintegración de 186,1 días. Esto significa que tarda 186,1 días en que la mitad de una muestra de 195Au se descomponga. La mayoría de los radioisótopos de oro se desintegran de diferentes maneras.
También se han estudiado al menos 32 isómeros nucleares del oro. Un isómero nuclear es una forma diferente de un mismo isótopo. El isómero más estable es el 198m²Au, con un periodo de semidesintegración de 2,27 días.
Compuestos del Oro
El oro forma muchos compuestos complejos, pero pocos compuestos sencillos. Por ejemplo, no se ha logrado aislar un óxido de oro con estado de oxidación I. Sin embargo, sí existe el AuO, que contiene oro con estados de oxidación 1+ y 3+.
El óxido de oro, Au2O3, se puede obtener como un polvo marrón. Este óxido es poco estable y se descompone en oro y oxígeno a 150 °C.
Al calentar polvo de oro con cloro a 200 °C, se forma el Au2Cl6, que es de color rojo. Este compuesto es muy importante para crear otros compuestos de oro. Si se calienta a 160 °C, produce AuCl.
El ion dicianoaurato, [Au(CN)2]-, es muy importante en la extracción de oro. Se forma fácilmente cuando el oro reacciona con soluciones de cianuros en presencia de aire o agua oxigenada.
El "tricloruro de oro" (Au2Cl6) y el "ácido cloroáurico" ((H3O)[AuCl4].3H2O) son algunos de los compuestos de oro más comunes. El ion tetracloroaurato(III), [AuCl4]-, se usa a veces como "oro líquido" para decorar cerámicas y vidrios. Cuando se calienta, deja una capa de oro.
El oro también puede formar grupos de átomos llamados clústeres. En estos grupos, los átomos de oro se unen entre sí. Algunos de estos compuestos también se conocen como "oro líquido".
Historia del Oro
El oro ha sido conocido y usado por los humanos desde hace miles de años, desde la Calcolítico. Se han encontrado objetos de oro de hace más de 6.000 años en los Balcanes, como los de la necrópolis de Varna. En Europa Central, se encontraron objetos de oro como sombreros y el disco celeste de Nebra de la Edad del Bronce.
El oro se menciona varias veces en el Antiguo Testamento. En el Antiguo Egipto, el faraón Dyer (alrededor del 3000 a.C.) tenía un jeroglífico de oro en su título. A lo largo de la historia, el oro ha sido uno de los metales más valiosos. Se ha usado mucho para hacer monedas y como "valor patrón" para el dinero.
En la antigüedad, algunas personas creían que comer en platos de oro podía alargar la vida. Durante la peste negra en Europa, algunos alquimistas pensaron que podían curar a los enfermos dándoles oro en polvo.
En América precolombina, culturas como la Cultura zapoteca y las del Antiguo Perú (como la cultura Chavín de Huántar) también trabajaron el oro. Lo usaban para adornos y ceremonias. Según los escritos de Bernal Díaz del Castillo, los Aztecas tenían una habitación secreta llena de objetos de oro en el palacio de Axayácatl. Los conquistadores tomaron estas riquezas, lo que llevó a la Noche Triste.
Los Incas tenían mucho oro en sus palacios y templos en Cusco. Ellos asociaban el oro con el sol Inti, su dios principal. Textos de conquistadores como Pedro Cieza de León describen una habitación en el Coricancha con paredes y objetos de oro. También había un jardín con animales de tamaño real hechos de este metal.
Cuando los conquistadores capturaron al emperador inca Atahualpa, él prometió llenar una habitación de oro para ser liberado. Aunque cumplió, los españoles lo ejecutaron. Ejemplos famosos de oro precolombino son el Tumi de oro de Lambayeque y la Máscara Sicán.
Los Muiscas de Colombia también adoraban el oro. Se dice que sus gobernantes se cubrían con polvo de oro en un lago. Estas historias pudieron dar origen a la leyenda de El Dorado.
Usos del Oro

La mayor parte del oro que se produce en el mundo (70%) se usa en joyería. Un 20% se guarda como reserva o para inversiones, y solo un 10% se usa en la industria.
El oro puro (de 24 quilates) es muy blando. Por eso, se mezcla con plata o cobre para hacerlo más duro. Estas mezclas, llamadas aleaciones, también pueden darle al oro diferentes tonos de color. El oro y sus aleaciones se usan mucho en joyería, para hacer monedas, como referencia monetaria, en medicina, en alimentos y bebidas, en la industria, en electrónica y en química.
El oro es valioso por su belleza, su resistencia a la corrosión y porque es fácil de trabajar. Debido a que es raro, se usó como moneda de cambio. Hoy en día, los países guardan reservas de oro puro en lingotes como símbolo de su riqueza.
En joyería, el oro se clasifica por quilates:
- Oro de 18 quilates: Tiene 18 partes de oro y 6 de otros metales (75% oro). Es muy brillante y vistoso, pero caro y no muy resistente.
- Oro de 14 quilates: Tiene 14 partes de oro y 10 de otros metales (58,33% oro). Es el más usado en joyería porque es más económico y resistente.
- Oro de 10 quilates: Tiene 10 partes de oro y 14 de otros metales (41,67% oro). Es el más sencillo.
Para obtener diferentes colores en joyería, se usan distintas aleaciones:
- Oro azul: 75% oro y 25% hierro.
- Oro gris: 75% oro, 15% níquel y 10% cobre.
- Oro rojo: 75% oro y 25% cobre.
- Oro rosa: 75% oro, 5% plata y 20% cobre.
- Oro amarillo: 75% oro, 12,5% plata y 12,5% cobre.
- Oro verde: 75% oro y 25% plata.
- Oro blanco: 75% oro, 16% paladio y 9% plata.
Es importante saber que, excepto el oro blanco, los otros "colores" de oro siguen siendo predominantemente amarillos, pero con un matiz diferente. Por ejemplo, el "oro verde" es amarillo con un toque verdoso.
Oro en la Medicina
Actualmente, el oro tiene algunos usos en medicina. Ciertos compuestos de oro se usan como antiinflamatorios para tratar la artritis reumatoide y otras enfermedades. No se sabe exactamente cómo funcionan estas sales de oro. El uso de oro en medicina se llama crisoterapia.
La mayoría de estos medicamentos se inyectan. Algunos son más solubles y se pueden tomar por la boca. Este tratamiento puede tener efectos secundarios leves, como problemas de piel o digestivos.
El cuerpo humano no absorbe bien el oro, pero sus compuestos pueden ser tóxicos. Se ha visto que hasta el 50% de los pacientes con artrosis tratados con oro han tenido problemas de hígado y riñones.
Más recientemente, se están investigando las nanopartículas de oro. Estas partículas muy pequeñas podrían usarse en sensores, imágenes médicas, para llevar medicamentos y en terapias con luz y calor.
El Oro como Inversión
- El oro se usa a menudo como una forma de proteger el dinero en tiempos de incertidumbre económica. Algunas personas guardan oro en lingotes o monedas para invertir.
- El código ISO 4217 para el oro como moneda es XAU.
- Las monedas de oro modernas para inversión suelen ser de oro puro (24 quilates). Sin embargo, algunas monedas famosas como el American Gold Eagle y el Soberano de Oro británico se siguen haciendo con 22 quilates, siguiendo la tradición. El Krugerrand sudafricano también es de 22 quilates.
- La moneda canadiense Hoja de Arce de Oro tiene una pureza muy alta, del 99,999%. Otras monedas populares son la Filarmónica de Viena y el Panda de Oro Chino.
Otros Usos del Oro
- El oro es fundamental en las comunicaciones, naves espaciales, motores de aviones de reacción y muchos otros productos.
- Gracias a su alta conductividad eléctrica y resistencia a la oxidación, se usa en capas finas sobre conexiones eléctricas para asegurar un buen contacto.
- Al igual que la plata, el oro puede formar amalgamas fuertes con el mercurio, que a veces se usaban en empastes dentales.
- El oro coloidal (partículas muy pequeñas de oro) es una solución de color intenso que se investiga para usos médicos y biológicos. También se usa como pintura dorada en cerámicas.
- El ácido cloroáurico se usa en fotografía.
- Un isótopo de oro, 198Au, con una vida media de 2,7 días, se usa en algunos tratamientos para enfermedades.
- Se usa para cubrir materiales biológicos que se observan con un microscopio electrónico.
- Se usa como recubrimiento protector en muchos satélites porque refleja bien la luz infrarroja.
- En la mayoría de las competencias deportivas, se entrega una medalla de oro al primer lugar, una de plata al segundo y una de bronce al tercero.
- Se ha empezado a usar en cremas faciales.
- Se utiliza para hacer flautas traveseras de alta calidad, ya que se calienta más rápido que otros materiales.
- En los primeros cables eléctricos se usó oro por su gran conductividad eléctrica, antes de ser reemplazado por plata y luego por cobre.
Minería del Oro

Como el oro es un metal que no reacciona fácilmente, a menudo se encuentra en su forma pura. A veces se encuentra en grandes pepitas, pero generalmente está en pequeñas cantidades dentro de otros minerales, en vetas de cuarzo, pizarra, rocas metamórficas y en depósitos de ríos. El oro está muy extendido y a menudo se encuentra junto a minerales como el cuarzo y la pirita. También se combina con teluro en minerales como la calaverita. Los romanos extraían mucho oro de Hispania, pero hoy en día muchas de esas minas están agotadas.
El oro se extrae de los minerales usando un proceso llamado lixiviación con cianuro. El cianuro ayuda a que el oro se disuelva en una solución. Para separar el oro, se vuelve a convertir en metal usando, por ejemplo, zinc. Se han buscado otras sustancias para reemplazar el cianuro debido a los problemas ambientales que causa, pero hasta ahora no han sido rentables o también son tóxicas. Muchas comunidades luchan contra las empresas mineras por los impactos que la extracción de oro con cianuro tiene en su entorno.
Hay una gran cantidad de oro en los mares y océanos, pero no existe un método rentable para extraerlo de allí.
El oro también se puede encontrar en los ríos. Algunas piedras de los ríos contienen pepitas de oro. La fuerza del agua separa las pepitas de la roca y las convierte en partículas muy pequeñas que se asientan en el fondo del río.
Los buscadores de oro encuentran estas partículas en los ríos usando la técnica del bateo. Usan una batea, que es un recipiente con forma de sartén. Llenan la batea con arena y agua del río y la mueven. Los materiales más pesados, como el oro, se quedan en el fondo, mientras que la arena se va.
El bateo de oro es una forma de separar mezclas de diferentes materiales.
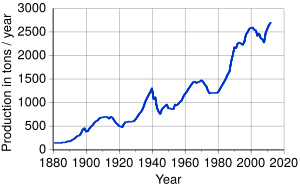
Producción Minera Mundial
En 2014, la producción mundial de oro fue de 2860 toneladas métricas. Los principales países productores fueron China, Australia y Rusia.
| País | Producción minera | Reservas | Base de reservas | |
|---|---|---|---|---|
| 2019 | 2020 | |||
| 380 | 380 | 2000 | - | |
| 325 | 320 | 10000 | - | |
| 305 | 300 | 7500 | - | |
| 200 | 190 | 3000 | - | |
| 175 | 170 | 2200 | - | |
| 142 | 140 | 1000 | - | |
| 139 | 130 | 2600 | - | |
| 128 | 120 | 2700 | - | |
| 111 | 100 | 1400 | - | |
| 107 | 100 | 1000 | - | |
| 105 | 90 | 2700 | - | |
| 90 | 80 | 2400 | - | |
| Otros países | 716 | 750 | 9200 | - |
| Total mundo (redondeado) | 3300 | 3200 | 53000 | - |
Países Exportadores de Oro
En 2019, los principales países que exportaron oro fueron Suiza, Reino Unido, Hong Kong, Estados Unidos, Emiratos Árabes Unidos, Australia, Sudáfrica, Turquía, Japón y Perú.
| N.º | País/Región | Valor de Exportación (en dólares) |
|---|---|---|
| - | Mundo | USD 308.000 millones |
| 1 | USD 65.300 millones | |
| 2 | USD 41.600 millones | |
| 3 | USD 40.800 millones | |
| 4 | USD 15.800 millones | |
| 5 | USD 13.400 millones | |
| 6 | USD 12.500 millones | |
| 7 | USD 10.000 millones | |
| 8 | USD 8.450 millones | |
| 9 | USD 5.740 millones | |
| 10 | USD 5.670 millones |
El oro es parte de un grupo de minerales importantes llamados 3TG. Estos minerales son esenciales para industrias como la electrónica y la automotriz. Existen leyes internacionales, como la ley estadounidense Dodd Frank y la Regulación de los Minerales de la UE, que buscan asegurar que estos minerales se obtengan de manera responsable.
Pruebas para el Oro
El método de ensayo al fuego es una forma de probar el oro. Consiste en fundir una muestra con otros materiales para obtener dos líquidos separados. Uno es una escoria (material de desecho) y el otro es plomo líquido. El plomo recoge el oro y la plata de la muestra. Como los dos líquidos no se mezclan y tienen diferentes densidades, se separan al enfriarse. El plomo sólido, con el oro y la plata, se separa de la escoria. Luego, el plomo se calienta en un recipiente especial y se absorbe, dejando solo el oro y la plata. Estos se pesan o se analizan con espectroscopia de absorción atómica.
Toxicidad del Oro
Algunos medicamentos que contienen oro, como el tiosulfato de oro o el tiomalato de sodio y oro, pueden causar efectos secundarios. Estos pueden incluir erupciones en la piel, problemas digestivos como náuseas y diarrea, y en casos más graves, daños en el hígado o los riñones. También pueden afectar la sangre. Si esto ocurre, se debe suspender el medicamento y tratar los síntomas.
El Oro en la Cultura Popular
El oro tiene muchos significados en el lenguaje y la cultura:
- La regla de oro es un principio moral importante.
- Cuando algo es muy valioso o apreciado, se dice que es “de oro”.
- “Oro negro” se refiere al petróleo, por ser una riqueza natural.
- “Oro rosa” puede referirse a los camarones.
- “Oro verde” se usa para el henequén en Yucatán, el aguacate en Michoacán, o las esmeraldas en Colombia.
- “Oro blanco” se usa para el platino, el algodón o el marfil (obtenido de los colmillos de elefantes). También se le llama así al litio cuando se encuentra en grandes cantidades.
- “Oro rojo” se refiere al coral rojo (Corallium rubrum) o al cobre rojo.
- “Oro líquido” se conoce al aceite de oliva, por su color similar.
- El miedo extremo al oro se llama crisofobia.
- Un proverbio popular dice: "No todo lo que brilla es oro", que significa que las apariencias pueden engañar.
- El oro no es necesario para la vida de ningún ser vivo.
- El oro laminado es una capa fina de oro sobre un metal menos valioso.
- Las tarjetas de crédito "Gold" a veces son doradas o tienen un baño de oro.
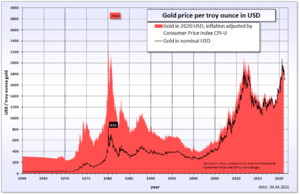
El Valor del Oro en la Historia Reciente
- El precio del oro puede cambiar mucho. Por ejemplo, el 16 de abril de 2013, el precio de una onza de oro bajó un 9%, el mayor descenso en un solo día desde 1983. En solo dos días, bajó un 13,5%.
- Después de alcanzar un mínimo en noviembre de 2013, el precio del oro subió a principios de 2014.
- El 4 de agosto de 2020, el precio del oro llegó a los 2000 dólares la onza por primera vez. Esto ocurrió porque la gente lo vio como un refugio seguro durante la incertidumbre económica causada por la crisis del COVID-19.
- El oro alcanzó su precio más alto en agosto de 2020, con 2.075 dólares la onza. En marzo de 2022, llegó a 2.070 dólares. Su máximo histórico fue de 2.135,40 dólares el 4 de diciembre de 2023.
|
Véase también
 En inglés: Gold Facts for Kids
En inglés: Gold Facts for Kids
- Iridio
- Pepita de oro
- Patrón oro
- Reserva de oro
- Crisofobia
- Tejido de oro
- Lingote de oro
- Fiebre de oro
- Envenenamiento por mercurio
- Cloruro de oro(III)