Actinio para niños
Datos para niños Radio ← Actinio → Torio |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Muestra de Actinio-225. Nótese el resplandor azulado que se origina por la ionización del aire por las partículas alfa.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Actinio, Ac, 89 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Actínidos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 3, 7, f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 227 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Rn] 6d1 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 32, 18, 9, 2 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Metal Plateado | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 195 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,1 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 3 (neutro) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 499 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 1170 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 10,070 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 1323 K (1050 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 3471 K (3198 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 62 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | cúbica centrada en las caras | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 12 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del actinio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El actinio (que viene del griego aktis, que significa "rayo luminoso") es un elemento químico con el símbolo Ac y el número atómico 89. Se encuentra en el grupo 3, periodo 7 y bloque f de la tabla periódica de los elementos. También le da nombre a una familia de elementos, los actínidos. Es un metal blando que brilla en la oscuridad debido a su radiactividad.
Se conocen muchos isótopos de actinio, desde el 209 hasta el 234. El más estable es el 227Ac, que tiene una vida media de 21.7 años. Esto significa que la mitad de una cantidad de 227Ac se descompone en otros elementos en ese tiempo. El 227Ac se encuentra en pequeñas cantidades en el uranio natural, y el 228Ac también existe en la naturaleza. Además, hay otros 22 isótopos de actinio creados por el ser humano, pero todos son inestables y duran muy poco tiempo.
El actinio fue descubierto por André-Louis Debierne en 1899. Su uso principal es como fuente de partículas alfa, que son un tipo de energía que liberan los elementos inestables.
Contenido
¿Qué hace especial al Actinio?
El actinio es un metal de color plateado. Como todos los actínidos, es radiactivo. Su fuerte radiactividad hace que brille con una luz azulada en la oscuridad.
El isótopo 227Ac se encuentra en cantidades muy pequeñas en los minerales de uranio. Este isótopo libera partículas alfa y partículas beta a medida que se descompone. Una tonelada de mineral de uranio contiene solo alrededor de 0.1 g de actinio.
El actinio se comporta de forma muy parecida a otros elementos llamados tierras raras, especialmente al lantano, que está justo encima de él en la tabla periódica. También es similar al radio, el elemento que lo precede.
¿Cómo se descubrió el Actinio?
El actinio fue descubierto en 1899 por el químico francés André-Louis Debierne. Él lo encontró en un mineral llamado pechblenda. Al principio, pensó que era similar al titanio (en 1899) y luego al torio (en 1900).
En 1902, Friedrich Oscar Giesel también descubrió este elemento de forma independiente. Él notó que era muy parecido al lantano y lo llamó "emanium" en 1904. Después de comparar las sustancias, se confirmó en 1904 que eran el mismo elemento. Se decidió usar el nombre propuesto por Debierne porque fue el primero en descubrirlo.
Otros elementos radiactivos también fueron descubiertos en esa época, como el polonio y el radio (por Marie y Pierre Curie) y el radón (por Friedrich Ernst Dorn).
¿Dónde se encuentra y cómo se obtiene?
Existen pocos compuestos conocidos de actinio, como AcF3, AcCl3, AcBr3, entre otros. Todos estos compuestos son muy parecidos a los del lantano, lo que sugiere que el actinio en ellos tiene un estado de oxidación de +3.
Aunque se encuentran pequeñas cantidades de actinio (227Ac) en minerales de uranio, la mayoría de las veces se obtienen pequeñas cantidades (como miligramos) de forma artificial. Esto se hace bombardeando 226Ra con neutrones en un reactor nuclear. Después, el radioisótopo 227Ra que se forma se descompone en 227Ac.
El metal actinio también se puede obtener calentando fluoruro de actinio con vapor de litio, magnesio o calcio a temperaturas muy altas (entre 1100 y 1300 grados Celsius). La primera vez que se produjo actinio de forma artificial fue en el Laboratorio Nacional Argonne en Chicago.
Isótopos del Actinio
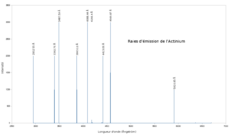
Los isótopos de actinio son versiones del elemento con diferente número de neutrones. El 227Ac es el único que se encuentra en la naturaleza y es el más estable de los más de treinta isótopos conocidos. Su periodo de semidesintegración es de 21.773 años. Otros isótopos importantes son el 225Ac (con una vida media de 10 días), el 226Ac (29.37 horas) y el 228Ac (6.13 horas). La mayoría de los demás isótopos duran menos de 10 horas, y muchos de ellos menos de un minuto.
El 227Ac tarda unos 185 días en alcanzar un equilibrio con los elementos en los que se descompone. Después de eso, sigue transformándose con su vida media de 21.773 años.
¿Para qué se usa el Actinio?
El actinio se usa casi exclusivamente en investigaciones científicas. Su radiactividad es unas 150 veces mayor que la del radio, lo que lo hace útil como fuente de neutrones. Aparte de esto, no tiene muchos usos importantes en la industria.
El francio, otro elemento radiactivo descubierto en 1939, se obtiene en pequeñas cantidades cuando el 227Ac se descompone como parte de la cadena radiactiva que empieza con el 235U.
Uso en la medicina
El isótopo 225Ac se utiliza en medicina para producir Bi-213, que se usa en tratamientos de radioterapia. Los científicos están investigando cómo combinar el 225Ac con ciertas proteínas (llamadas anticuerpos monoclonales) para crear un tratamiento que pueda atacar células específicas.
Por ejemplo, una combinación llamada "225Ac-HuM195" libera radiación alfa directamente a las células que tienen una proteína específica en su superficie. Esto ayuda a destruir esas células sin dañar tanto el tejido sano cercano, a diferencia de tratamientos anteriores que usaban otro tipo de radiación. El 225Ac es más potente que el 213Bi porque dura más tiempo.
¿Es peligroso el Actinio?
Sí, el 227Ac es extremadamente radiactivo. Si se ingiere, incluso en cantidades muy pequeñas, puede causar daños muy serios a la salud. Por eso, se maneja con mucho cuidado en laboratorios especializados.
Véase también
 En inglés: Actinium Facts for Kids
En inglés: Actinium Facts for Kids
- Eka-actinio
- Elementos del bloque f
- Elementos del grupo 3
- Acetilo (también abreviado Ac)
- Marguerite Perey

