Neón para niños
Datos para niños Flúor ← Neón → Sodio |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Tubo de descarga lleno de neón
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Neón, Ne, 10 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Gases nobles | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 18, 2, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 20,1797 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [He] 2s2 2p6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Incoloro. Exhibe un brillo rojo anaranjado cuando se coloca en un campo eléctrico. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | Sin datos pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 38 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 69 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de van der Waals | 154 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 0 (desconocido) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 2080,7 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 3952,3 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª energía de ionización | 6122 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª energía de ionización | 9371 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5.ª energía de ionización | 12 177 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6.ª energía de ionización | 15 238 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7.ª energía de ionización | 19 999 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8.ª energía de ionización | 23 069 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Gas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 0,8999 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 24,56 K (−249 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 27,104 K (−246 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 1,7326 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 0,3317 sublima: 105 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | No aplicable | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Cúbica centrada en las caras | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 1030,1 J/(kg·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | Sin datos S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 0,0493 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 435 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del neón | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El neón es un elemento químico con el número atómico 10. Su símbolo es Ne y su masa atómica es de 20.1797. Es un gas noble, lo que significa que es muy estable y no reacciona fácilmente con otros elementos. El neón no tiene color y se encuentra en pequeñas cantidades en el aire. Es muy común en el universo. Cuando se usa en lámparas especiales, el neón produce una luz de color rojo anaranjado muy brillante.
Contenido
¿Cómo se descubrió el neón?
El neón fue descubierto en 1898 por dos químicos británicos, William Ramsay y Morris Travers, en Londres. Ellos encontraron el neón mientras estudiaban el aire.
Para descubrirlo, Ramsay y Travers enfriaron una muestra de aire hasta que se volvió líquida. Luego, calentaron ese líquido y recogieron los gases a medida que se evaporaban. Ya habían identificado gases como el nitrógeno, el oxígeno y el argón. Después de un tiempo, lograron separar un gas que, al recibir una descarga eléctrica, brillaba con una luz roja intensa.
Este nuevo gas fue llamado neón. La palabra "neón" viene del griego neos, que significa "nuevo". El brillo rojo anaranjado que producía el neón fue una característica que notaron de inmediato. Morris Travers describió el momento como "un espectáculo para contemplar y nunca olvidar".
¿Cuándo se empezó a usar el neón en la iluminación?
Al principio, el neón era difícil de conseguir. Esto impidió que se usara rápidamente en lámparas. Sin embargo, después de 1902, una empresa francesa llamada Air Liquide, dirigida por Georges Claude, empezó a producir neón en grandes cantidades. Lo obtenían como un subproducto al licuar el aire.
En diciembre de 1910, Georges Claude mostró por primera vez la iluminación moderna de neón usando un tubo sellado con este gas. Al principio, intentó vender estas luces para interiores, pero la gente no las quería por su color tan intenso.
En 1912, un socio de Claude tuvo una idea mejor: vender los tubos de neón como letreros llamativos para publicidad. ¡Fue un éxito inmediato! En 1923, los letreros de neón llegaron a Estados Unidos. Un concesionario de autos Packard en Los Ángeles compró dos grandes letreros. El brillo y el color rojo intenso hicieron que su publicidad destacara mucho. Los letreros de neón transformaron las ciudades con sus anuncios brillantes.
Propiedades y características del neón

El neón es el segundo gas noble más ligero. Es un gas incoloro, pero cuando se le aplica electricidad, brilla con un color rojo anaranjado.
Aquí tienes algunas de sus propiedades principales:
- Peso atómico: 20,180 u
- Punto de ebullición: 27,10 K (equivalente a -246 °C)
- Punto de fusión: 24,56 K (equivalente a -248,6 °C)
- Densidad: 1,20 g/ml (a -246 °C)
El neón líquido es un excelente refrigerante. Puede enfriar cosas 40 veces mejor que el helio líquido y tres veces mejor que el hidrógeno líquido. Sin embargo, es más caro de usar que el helio porque es más difícil de conseguir.
Usos y aplicaciones del neón
El neón es famoso por su luz rojo-anaranjada. Por eso, se usa mucho en los letreros publicitarios. Aunque a veces se les llama "tubos de neón" a otros letreros de colores diferentes, estos en realidad contienen otros gases.
Otros usos importantes del neón incluyen:
- Se usa en indicadores de alto voltaje.
- Forma parte de los tubos de las televisiones antiguas.
- Combinado con helio, se utiliza para crear un tipo de láser.
- El neón líquido se vende como un refrigerante criogénico, es decir, para enfriar a temperaturas muy bajas.
- También se usa el neón líquido en lugar del nitrógeno líquido para refrigeración.
Existen dos tipos principales de luces de neón:
- Las lámparas de neón pequeñas: Son de tamaño reducido y funcionan con voltajes bajos (entre 100 y 250 voltios). Se usaban mucho como luces indicadoras o para probar circuitos. Hoy en día, las luces led las han reemplazado en muchos de estos usos.
- Los letreros de neón grandes: Estos funcionan con voltajes mucho más altos (de 2 a 15 kilovoltios) y sus tubos pueden medir varios metros de largo.
¿Dónde se encuentra el neón?
El neón se produce principalmente en forma de gas. La atmósfera terrestre contiene una pequeña cantidad de neón, aproximadamente 65,8 partes por millón (ppm). Se obtiene enfriando el aire hasta que se vuelve líquido y luego separando el neón de ese líquido. En la corteza terrestre, es aún más raro, con solo 0,005 ppm.
En el espacio, el neón es mucho más común. Es el quinto elemento químico más abundante en el universo, después del hidrógeno, el helio, el oxígeno y el carbono.
Los tipos de neón más comunes, llamados isótopos estables, se forman en las estrellas. El isótopo más abundante, el neón-20 (20Ne), se crea cuando el carbono se fusiona dentro de estrellas muy grandes y calientes. Esto ocurre a temperaturas extremadamente altas, que solo se encuentran en el centro de estrellas con más de 8 veces la masa de nuestro Sol.
El neón es raro en la Tierra porque es muy ligero y no se "pega" fácilmente a las nubes de polvo y gas que formaron nuestro planeta. Por eso, gran parte del neón original de la Tierra se escapó al espacio. El neón es un gas monoatómico, lo que significa que sus átomos están solos, no forman moléculas como el nitrógeno o el oxígeno. Esto lo hace más ligero que el aire, por lo que un globo lleno de neón flotaría, aunque más lento que uno de helio.
La sonda espacial Galileo descubrió que en la atmósfera de Júpiter, la cantidad de neón es mucho menor de lo esperado. Esto sugiere que los bloques de hielo que formaron Júpiter podrían haberse creado en una zona del sistema solar que era demasiado cálida para retener el neón.
¿El neón forma compuestos?
Aunque el neón es un gas noble y casi no reacciona, los científicos han logrado crear un compuesto con flúor en el laboratorio. No se sabe si este o algún otro compuesto de neón existe de forma natural.
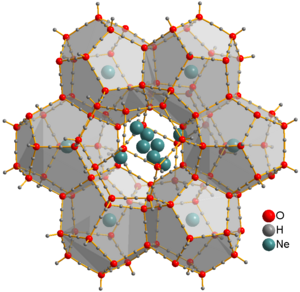
Se han observado algunas combinaciones de neón con otros átomos en experimentos de laboratorio. Por ejemplo, se sabe que el neón puede formar un tipo de hidrato, que es una sustancia inestable con agua.
También se han encontrado cantidades más altas de neón-20 en diamantes y en gases de volcanes. Esto hace pensar que podría haber reservas de neón "solar" (similar al que se encuentra en el Sol) dentro de la Tierra.
Galería de imágenes
Véase también
 En inglés: Neon Facts for Kids
En inglés: Neon Facts for Kids