Carbono para niños
Datos para niños Boro ← Carbono → Nitrógeno |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 A la derecha, fragmento de carbono vitrificado de 570 g. A la izquierda, pequeño cubo de grafito (1 cm3 de volumen).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Carbono, C, 6. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | No metales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 14, 2, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 12,0107 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [He] 2s2 2p2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Mohs | 1-2 (grafito) 10 (diamante) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Negro (grafito) Incoloro (diamante) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 70 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 2,55 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 67 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 77 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de van der Waals | 170 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | ±4, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óxido | Ácido débil | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 1086,5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 2352,6 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª energía de ionización | 4620,5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª energía de ionización | 6222,7 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5.ª energía de ionización | 37 831,1 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6.ª energía de ionización | 47 277,1 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido (no magnético) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 2267 kg/m³ kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | Grafito: 3500 K (3227 °C) °C Diamante: 3800 K (3527 °C) °C |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | Grafito: 3500 K (3227 °C) °C (sublima, no tiene fase líquida) Diamante: 4830 K (4557 °C) °C |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | Grafito; sublima: 711 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | Grafito; sublima: 105 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | hexagonal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 710 J/(kg·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | 61×103 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 129 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | Diamante: 18.350 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del carbono | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El carbono (del latín, carbo, que significa 'carbón') es un elemento químico con el símbolo C. Su número atómico es 6 y su masa atómica es de 12,01. Es un no metal y puede formar cuatro enlaces químicos, lo que lo hace muy versátil. Tiene 6 electrones y 6 protones.
Existen tres isótopos del carbono que se encuentran en la naturaleza: el 12C y el 13C que son estables, y el isótopo radiactivo 14C. Este último se descompone lentamente con una vida media de unos 5730 años.
El carbono es uno de los pocos elementos conocidos desde hace mucho tiempo. Es la base de la química orgánica, que estudia los compuestos de los seres vivos. Lo encontramos en la Tierra de varias formas: como elemento puro (en el carbón y los diamantes), en compuestos inorgánicos (como el dióxido de carbono y el carbonato de calcio), y en compuestos orgánicos (como la biomasa, el petróleo y el gas natural). También se han creado nuevas formas de carbono, como el carbón activado, el negro de humo, las fibras de carbono, los nanotubos, los fullerenos y el grafeno.
El carbono es el elemento número 15 más abundante en la corteza terrestre. En el universo, es el cuarto elemento más abundante en masa, después del hidrógeno, el helio y el oxígeno. Gracias a su abundancia y a su capacidad única para formar muchos compuestos orgánicos y polímeros (cadenas largas de moléculas) a las temperaturas de la Tierra, el carbono es un componente esencial de toda la vida conocida. Es el segundo elemento más abundante en el cuerpo humano por masa, representando aproximadamente el 18,5%.
Los átomos de carbono pueden unirse de diferentes maneras, creando lo que se llama alótropos del carbono. Los más conocidos que se encuentran en la naturaleza son el grafito, el diamante y el carbono amorfo. Las propiedades físicas del carbono cambian mucho según su forma. Por ejemplo, el grafito es oscuro y no transparente, mientras que el diamante es muy transparente. El grafito es blando y se usa en los lápices (su nombre viene del griego "γράφειν", que significa 'escribir'), mientras que el diamante es el material natural más duro que conocemos. El grafito conduce bien la electricidad, pero el diamante no. En condiciones normales, el diamante, los nanotubos de carbono y el grafeno son los materiales que mejor conducen el calor. Todos los alótropos del carbono son sólidos a temperatura ambiente. Son resistentes a los químicos y necesitan temperaturas muy altas para reaccionar, incluso con oxígeno.
El carbono forma más compuestos que cualquier otro elemento, con casi diez millones de compuestos descritos hasta ahora. Por esta razón, a menudo se le llama el "rey de los elementos".
Quemar carbono en todas sus formas ha sido clave para el desarrollo tecnológico desde hace mucho tiempo. Los materiales hechos de carbono se usan en muchas áreas de la tecnología moderna, como en materiales compuestos, baterías, para limpiar el aire y el agua, y en la fabricación de aluminio.
Contenido
¿Qué hace al carbono tan especial?
El carbono es un elemento muy interesante por varias razones. Sus diferentes formas incluyen una de las sustancias más blandas (el grafito) y una de las más duras (el diamante). También es uno de los materiales más baratos (carbón) y uno de los más caros (diamante).
Además, el carbono tiene una gran capacidad para unirse con otros átomos pequeños, incluyendo otros átomos de carbono. Esto le permite formar cadenas muy largas. Su tamaño pequeño también le permite formar enlaces múltiples.
- Con el oxígeno, forma el dióxido de carbono, que es vital para el crecimiento de las plantas (mira el ciclo del carbono).
- Con el hidrógeno, forma muchos compuestos llamados hidrocarburos, que son importantes para la industria y el transporte, como los combustibles.
- Combinado con oxígeno e hidrógeno, forma una gran variedad de compuestos, como los ácidos grasos, que son esenciales para la vida, y los ésteres que dan sabor a las frutas.
- También ayuda a transportar parte de la energía que produce el Sol a través del ciclo carbono-nitrógeno.
Formas del carbono: Alótropos
Conocemos cinco formas principales del carbono, además del carbono amorfo: grafito, diamante, fullereno, grafeno y carbino.
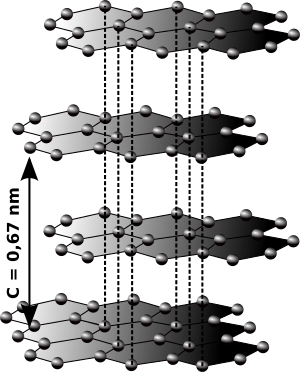
El grafito es una de las formas más comunes del carbono. Sus átomos están organizados en capas de hexágonos. Es de color negro, no transparente y blando, por eso se usa en las minas de los lápices. Aunque el grafito y el diamante están hechos de los mismos átomos de carbono, su diferente organización les da propiedades muy distintas.
Los diamantes naturales se forman en el interior de la Tierra bajo mucha presión y altas temperaturas. Su estructura es como una red tridimensional muy fuerte. A diferencia del grafito, el diamante es muy duro, con una dureza de 10 en la escala de Mohs. Los diamantes también se pueden crear en laboratorios, sometiendo el grafito a temperaturas y presiones muy altas. Estos diamantes artificiales tienen la misma dureza, color y transparencia que los naturales.
El carbono amorfo es como el grafito, pero sus átomos no forman una estructura cristalina grande y ordenada. Se encuentra en la mayoría de los carbones y en el hollín.
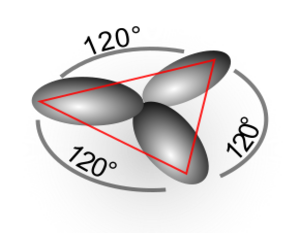
A presión normal, el carbono se presenta como grafito. En esta forma, cada átomo de carbono se une a otros tres en un plano de hexágonos. El grafito conduce la electricidad porque tiene electrones que se mueven libremente entre sus capas. Es un material blando y sus capas se deslizan fácilmente una sobre otra, lo que lo hace útil como lubricante.
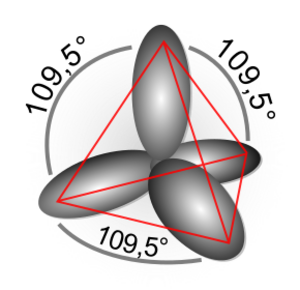
A presiones muy altas, el carbono se convierte en diamante. En el diamante, cada átomo de carbono se une a otros cuatro átomos de carbono. Gracias a la fuerza de estos enlaces, el diamante es una de las sustancias más duras que se conocen. La transformación de diamante a grafito a temperatura ambiente es tan lenta que no se puede notar.
Los fullerenos se descubrieron hace unos 15 años. Tienen una estructura parecida al grafito, pero con formas de pentágonos y hexágonos que hacen que los planos se curven, formando estructuras como esferas o cilindros. El fullereno más conocido tiene 60 átomos de carbono y se parece a un balón de fútbol.
Los nanotubos de carbono también pertenecen a esta familia. Son como capas de grafito enrolladas en forma de cilindro. Son uno de los primeros productos importantes de la nanotecnología.
Usos y aplicaciones del carbono
El uso más importante del carbono en la industria es como parte de los hidrocarburos, especialmente en los combustibles fósiles como el petróleo y el gas natural. Del petróleo se obtienen gasolinas, queroseno y aceites, y es la base para fabricar plásticos. El gas natural se usa cada vez más como fuente de energía porque su combustión es más limpia.
Otros usos del carbono son:
- El carbono-14, un radioisótopo descubierto en 1940, se usa para saber la edad de objetos antiguos de origen orgánico (datación radiométrica).
- El grafito se mezcla con arcilla para hacer las minas de los lápices. También se usa como aditivo en lubricantes y en pinturas especiales.
- El diamante se usa para hacer joyas y como material de corte por su gran dureza.
- Es un elemento clave en la fabricación de aceros.
- Las pastillas de carbón se usan en medicina para ayudar a absorber sustancias no deseadas en el sistema digestivo.
- El carbón activado se usa para filtrar y purificar el agua.
- El carbono amorfo (hollín) se añade a la goma para mejorar sus propiedades. También se usa en la fabricación de electrodos para baterías.
- Los fullerenos se investigan para usos en medicina, por ejemplo, se ha probado que un tipo de fullereno puede ayudar a combatir ciertos virus.
- La fibra de carbono se usa para fabricar materiales muy resistentes, como raquetas de tenis y bicicletas de alta calidad, porque son ligeras y fuertes.
- Las propiedades de los fullerenos, especialmente los nanotubos, prometen muchos usos futuros en el campo de la nanotecnología.
Breve historia del carbono
El carbono fue descubierto en la prehistoria y ya se conocía en la antigüedad. Se producía quemando materiales orgánicos de forma incompleta para obtener carbón. Los fullerenos, una de las formas más recientes de carbono, se descubrieron en la década de 1980 durante experimentos con gases.
En 1704, Isaac Newton pensó que el diamante podría quemarse. Sin embargo, no fue hasta 1772 que Antoine Lavoisier demostró que al quemar un diamante se producía dióxido de carbono.
Smithson Tennant probó en 1797 que el diamante era carbono puro. En 1961, el 12C se eligió como la base para medir la masa atómica de todos los elementos.
Los primeros compuestos de carbono se encontraron en la materia viva a principios del siglo XIX. Por eso, el estudio de los compuestos de carbono se llamó química orgánica.
¿Dónde encontramos el carbono?
El carbono no se formó durante el Big Bang (el inicio del universo) porque el universo se expandió y enfrió muy rápido. Sin embargo, este elemento es muy abundante en el interior de las estrellas y en otros cuerpos celestes como los cometas y las atmósferas de los planetas. Algunos meteoritos contienen pequeños diamantes que se formaron cuando nuestro sistema solar apenas estaba naciendo.
En la Tierra, el carbono se encuentra en la atmósfera y disuelto en el agua. También forma grandes masas de rocas como la caliza y el mármol, combinado con otros elementos como el calcio y el magnesio.
El grafito se encuentra en grandes cantidades en países como Rusia, Estados Unidos, México, Groenlandia y la India.
Los diamantes naturales se encuentran en rocas volcánicas. Los mayores yacimientos de diamantes están en África (como Sudáfrica y Botsuana), y también hay depósitos importantes en Canadá, Rusia, Brasil y Australia.
Compuestos inorgánicos del carbono
El dióxido de carbono (CO2) es el óxido de carbono más importante. Es una pequeña parte de la atmósfera terrestre (aproximadamente el 0,04%) y es producido y usado por los seres vivos (ver ciclo del carbono). En el agua, forma pequeñas cantidades de ácido carbónico (H2CO3), que son las burbujas en muchos refrescos.
Otros óxidos son el monóxido de carbono (CO) y el menos común subóxido de carbono (C3O2). El monóxido de carbono se forma cuando los materiales orgánicos no se queman por completo. Es un gas sin color ni olor. Es muy peligroso porque se une fácilmente a la hemoglobina de la sangre, impidiendo que el oxígeno llegue a nuestro cuerpo.
El carbono también forma compuestos con metales, llamados carburos y acetiluros. Aunque el carbono tiene una electronegatividad alta, puede formar carburos covalentes como el carburo de silicio (SiC), que tiene propiedades similares a las del diamante.
Isótopos del carbono
En 1961, la IUPAC (una organización internacional de químicos) eligió el 12C como la base para medir la masa atómica de todos los elementos químicos.
El carbono-14 es un radioisótopo con una periodo de semidesintegración de 5730 años. Se usa mucho para determinar la edad de objetos antiguos que provienen de seres vivos.
Los isótopos de carbono que se encuentran de forma natural y son estables son el 12C (98,89%) y el 13C (1,11%).
Consejos de seguridad
Algunos compuestos de carbono pueden ser peligrosos. El monóxido de carbono, que se encuentra en los gases de escape de los motores, y el cianuro son muy peligrosos para los mamíferos, incluyendo a las personas. Los gases orgánicos como el eteno, el etino y el metano pueden ser explosivos e inflamables si hay aire presente. Sin embargo, muchos otros compuestos de carbono no son peligrosos y son esenciales para la vida.
El carbono puro es muy seguro para los humanos y se puede manipular o incluso ingerir en forma de grafito o carbón vegetal. No se disuelve ni reacciona fácilmente con los químicos del cuerpo. Por eso, si entra en los tejidos, es probable que se quede allí por mucho tiempo. Por ejemplo, se ha encontrado que Ötzi el hombre del hielo tenía tatuajes hechos con carbón que se conservaron durante su vida y 5200 años después de su muerte.
Sin embargo, inhalar grandes cantidades de polvo de carbón o hollín (negro de carbón) puede ser dañino, ya que puede irritar los pulmones y causar una enfermedad. De manera similar, el polvo de diamante, que se usa como abrasivo, puede ser perjudicial si se ingiere o inhala. Las pequeñas partículas de carbono de los gases de escape de los motores diésel también pueden acumularse en los pulmones al ser inhaladas. En estos casos, los efectos dañinos pueden deberse a otras sustancias mezcladas con el carbono, como químicos orgánicos o metales pesados, más que al carbono en sí.
El carbono generalmente tiene una baja peligrosidad para la mayoría de los seres vivos en la Tierra. Sin embargo, para algunas criaturas, puede ser perjudicial. Por ejemplo, las nanopartículas de carbono pueden ser dañinas para la Drosophila (mosca de la fruta).
El carbono también puede quemarse con mucha fuerza y brillo en presencia de aire a altas temperaturas, como ocurrió en el Incendio de Windscale, que fue causado por la liberación repentina de energía acumulada en el grafito. Grandes cantidades de carbón, que han estado inactivas por millones de años sin oxígeno, pueden encenderse espontáneamente al ser expuestas al aire, por ejemplo, en los desechos de las minas de carbón.
Entre la gran variedad de compuestos de carbono, se encuentran sustancias muy peligrosas como la tetradotoxina, la ricina (una sustancia de las semillas de ricino) y el monóxido de carbono.
Ver también
- Carbono 14
- Compuesto orgánico
- Cambio climático
- Huella de carbono
- Economía baja en carbono
- Objetivos de Desarrollo Sostenible
- Central termoeléctrica
Galería de imágenes
Véase también
 En inglés: Carbon Facts for Kids
En inglés: Carbon Facts for Kids