Iridio para niños
Datos para niños Osmio ← Iridio → Platino |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Iridio, Ir, 77 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Metales de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 9, 6, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 192,217 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Xe] 4f14 5d7 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 32, 15, 2 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Blanco plateado | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 2,20 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 136 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 141±6 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | −3,−1, 0, 1, 2, 3, 4, 5, 6, 9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 880 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 1600 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 22 562 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 2739 K (2466 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 4701 K (4428 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 563 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 41,12 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Cúbica centrada en las caras | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 147 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo elástico | 528 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 4825 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del iridio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El iridio es un elemento químico con el número atómico 77. Su símbolo es Ir. Se encuentra en el grupo 9 de la tabla periódica. Es un metal de transición que forma parte del grupo del platino.
El iridio es un metal muy especial. Es duro, frágil y pesado, con un color blanco plateado. Es el segundo elemento más denso que conocemos, solo superado por el osmio. Además, es el elemento más resistente a la corrosión. Esto significa que casi nada puede dañarlo, ni siquiera a temperaturas muy altas, como 2000 °C. Solo algunos halógenos y sales muy calientes pueden corroerlo. Sin embargo, el iridio en polvo es más reactivo y puede incluso incendiarse.
Fue descubierto en 1803. El científico Smithson Tennant lo encontró entre las impurezas del platino natural. Le puso el nombre de iridio en honor a la diosa griega Iris, que representaba el arcoíris. Esto fue porque las sales de iridio tienen muchos colores llamativos. El iridio es uno de los elementos más escasos en la corteza terrestre. Cada año solo se extraen y usan unas tres toneladas. Los isótopos 191Ir y 193Ir son los dos tipos naturales de iridio y son estables. El 193Ir es el más común.
Los compuestos de iridio se usan en la industria y en la investigación. Por ejemplo, se utilizan en la catálisis industrial. El iridio metálico es útil cuando se necesita un material muy resistente a la corrosión y al calor. Se encuentra en bujías de alta calidad, en recipientes para fabricar semiconductores y en electrodos para producir cloro. Algunos radioisótopos de iridio se usan en ciertos generadores especiales.
El iridio es mucho más común en los meteoritos que en la Tierra. Por eso, cuando se encontró una gran cantidad de iridio en una capa de arcilla que marca el final del período Cretácico, se propuso una idea importante. Esta idea, llamada la hipótesis de Álvarez, sugiere que el impacto de un gran asteroide causó la desaparición de los dinosaurios y muchas otras especies hace 65 millones de años.
El iridio también se mezcla con otros metales para crear aleaciones muy fuertes. Estas aleaciones pueden soportar temperaturas muy altas. Se usa en contactos eléctricos y en aparatos que funcionan a altas temperaturas. También sirve para hacer que el platino sea más duro.
Contenido
¿Cómo es el Iridio?
El iridio es un metal de color blanco, similar al platino, pero con un ligero tono amarillo. Es muy difícil de trabajar porque es extremadamente duro y se rompe con facilidad. Es el metal más resistente a la corrosión. Esto significa que no se disuelve con la mayoría de los ácidos, ni siquiera con el agua regia. Para disolverlo, se necesita una mezcla especial de ácido clorhídrico y clorato de sodio a altas temperaturas.
El iridio es muy raro en la corteza terrestre, con una concentración muy pequeña. Sin embargo, es más común en los meteoritos. Se cree que hay mucho iridio en el núcleo de la Tierra, junto con el hierro y el níquel.
Propiedades Físicas del Iridio
El iridio pertenece a los metales del grupo del platino. Debido a su gran dureza, fragilidad y su alto punto de fusión (la temperatura a la que se derrite), es complicado darle forma cuando está sólido. Por eso, se suele trabajar en forma de polvo. Es el único metal que mantiene sus buenas propiedades a temperaturas por encima de los 1600 °C. El iridio tiene un punto de ebullición muy alto y se convierte en superconductor a temperaturas muy bajas, cerca de los 0.14 K.
El iridio es el segundo elemento más rígido, solo superado por el osmio. Esto, junto con otras propiedades, muestra lo difícil que es deformarlo. A pesar de su dificultad para manipularlo y su alto costo, el iridio es muy valioso. Se usa en tecnologías modernas que necesitan materiales muy resistentes en condiciones extremas.
La densidad del iridio es muy similar a la del osmio, el elemento más denso. Durante un tiempo, no se sabía con certeza cuál era más denso. Pero con mediciones más precisas, se determinó que el iridio tiene una densidad de 22,56 g/cm³ y el osmio de 22,59 g/cm³.
Propiedades Químicas del Iridio
El iridio es el metal más resistente a la corrosión que se conoce. Casi ningún ácido, metal derretido o silicato a altas temperaturas puede dañarlo. Sin embargo, algunas sales derretidas, como el cianuro de sodio y el cianuro de potasio, pueden atacarlo. También puede reaccionar con el oxígeno y los halógenos (especialmente el flúor) a altas temperaturas.
Compuestos de Iridio
El iridio puede formar compuestos con diferentes estados de oxidación, desde -3 hasta +6. Los más comunes son +3 y +4. Algunos ejemplos de compuestos de iridio son:
- Dióxido de iridio (IrO2): un polvo de color marrón.
- Tricloruro de iridio (IrCl3): se usa para crear otros compuestos de iridio.
- Hexafluoruro de iridio (IrF6): un sólido amarillo muy reactivo.
Los compuestos de iridio con cloro, como el H2IrCl6 y su sal de amonio, son muy importantes en la industria. Se usan para purificar el iridio y para fabricar otros compuestos.
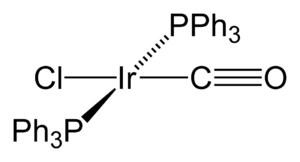
El iridio también forma compuestos especiales con carbono, llamados compuestos organoirídicos. Un ejemplo famoso es el complejo de Vaska, que puede unirse a la molécula de oxígeno. Otro es el catálisis de Crabtree, usado en reacciones químicas para crear nuevas sustancias.
Isótopos del Iridio
Isótopos de iridio El iridio tiene dos isótopos naturales que son estables: el 191Ir y el 193Ir. El 191Ir representa el 37.3% del iridio natural, y el 193Ir el 62.7%.
Además de los isótopos estables, se han creado al menos 34 radioisótopos de iridio en laboratorios. El 192Ir es el radioisótopo más estable, con una vida media de 73.827 días. Este isótopo se descompone en los dos isótopos estables.
El isótopo 191Ir fue el primero en mostrar el efecto Mößbauer. Este efecto es muy útil para estudiar materiales en campos como la física, la química y la metalurgia.
Historia del Descubrimiento
El iridio fue descubierto al mismo tiempo que el platino y otros metales de su grupo. Las antiguas culturas de Etiopía y Sudamérica ya usaban el platino, que a menudo contenía iridio. El platino llegó a Europa en el siglo XVII desde Colombia. Al principio, se pensó que era una aleación, pero en 1748 se descubrió que era un nuevo elemento.

Los químicos que estudiaban el platino notaron que, al disolverlo en agua regia, siempre quedaba un residuo oscuro. En 1803, el científico británico Smithson Tennant analizó este residuo. Concluyó que contenía un nuevo metal. Tennant realizó varias reacciones y obtuvo cristales de color rojo oscuro. Llamó a este nuevo elemento iridio, en honor a la diosa griega Iris, por los colores de sus sales. El descubrimiento se anunció el 21 de junio de 1804.
En 1813, John George Children fue el primero en derretir una muestra de iridio. En 1842, Robert Hare obtuvo iridio puro por primera vez. Descubrió que era muy denso, no se podía moldear y era extremadamente duro.
En 1860, Henri Sainte-Claire Deville y Jules Henri Debray lograron fundir una cantidad importante de iridio. Fue un proceso muy difícil, que requirió grandes cantidades de oxígeno e hidrógeno. Estas dificultades han limitado el uso del iridio.
En 1834, John Isaac Hawkins usó iridio para crear una punta fina y dura para una pluma de oro. Más tarde, en 1880, John Holland y William Lofland Dudley patentaron un proceso para fundir iridio usando fósforo.
En 1957, Rudolf Ludwig Mößbauer descubrió un efecto especial en los átomos de iridio-191. Este fenómeno, conocido como el Efecto Mößbauer, le valió el premio nobel de física en 1961.
¿Dónde se Encuentra el Iridio?

El iridio es uno de los elementos menos abundantes en la corteza terrestre. Por ejemplo, el oro es 40 veces más común, y el platino 10 veces más. Solo el renio, el rutenio y el rodio son menos abundantes que el iridio.
En contraste, el iridio es bastante común en los meteoritos. Se puede encontrar en la naturaleza como un elemento puro o mezclado con otros metales, especialmente con osmio y platino. También se halla en depósitos de níquel y cobre.
Las mayores reservas de iridio se encuentran en el complejo ígneo Bushveld en Sudáfrica. También hay depósitos importantes en Rusia y Canadá. Pequeñas cantidades se han encontrado en los Estados Unidos. El iridio también se puede obtener de depósitos aluviales, donde se mezcla con platino. Estos depósitos fueron explotados por culturas antiguas en Colombia y siguen siendo una fuente de metales del grupo del platino.
Iridio y la Extinción de los Dinosaurios

Extinción masiva del Cretácico-Paleógeno|l1=Extinción masiva del Cretácico-Terciario Hace unos 65 millones de años, una delgada capa de arcilla rica en iridio marca el límite entre el período Cretácico y el Cenozoico. En 1980, un equipo liderado por Luis Walter Álvarez sugirió que este iridio provenía de un asteroide o cometa que impactó la Tierra. Esta idea, conocida como la hipótesis Álvarez, es la más aceptada para explicar la desaparición de los dinosaurios. Se encontró un gran cráter de impacto de esa época en la península de Yucatán, llamado el cráter de Chicxulub.
Algunos científicos, como Dewey M. McLean, creen que el iridio podría tener un origen volcánico. Esto se debe a que el núcleo de la Tierra es rico en iridio, y volcanes activos aún liberan este metal.
Producción de Iridio
El iridio se obtiene como un subproducto de la minería de níquel y cobre. Durante el proceso de purificación de estos metales, el iridio, junto con la plata, el oro y otros metales del grupo del platino, se deposita en el fondo de los tanques. Este material se llama "barro anódico" y es el punto de partida para extraer el iridio.
Para separar el iridio, el barro se disuelve en una solución. Hay varios métodos, como fundirlo con peróxido de sodio y luego disolverlo en agua regia, o usar una mezcla de cloro y ácido clorhídrico.
Una vez disuelto, el iridio se separa de los otros metales del platino. Luego, se usa hidrógeno para convertirlo en polvo o una esponja metálica. Este polvo se puede usar en técnicas de metalurgia.
En el año 2000, la producción mundial de iridio fue de unas 3 toneladas. El precio del iridio ha variado mucho a lo largo de los años. Esta variación se debe a la oferta, la demanda, la especulación y la inestabilidad en los países productores.
Usos del Iridio
El iridio y sus aleaciones son muy útiles debido a su alto punto de fusión, dureza y resistencia a la corrosión.
Usos Industriales y Médicos
- Piezas resistentes: El iridio y sus aleaciones con platino u osmio se desgastan muy poco. Se usan en piezas de motores de avión y en tuberías submarinas.
- Endurecedor: El iridio se usa para hacer que el platino sea mucho más duro.
- Dispositivos de alta temperatura: Se fabrican recipientes de iridio para producir cristales que se usan en computadoras y láseres.
- Contactos eléctricos: La resistencia del iridio al desgaste lo hace ideal para los contactos eléctricos en bujías.
- Catalizadores: Los compuestos de iridio se usan como catalizadores en procesos industriales, como la producción de ácido acético. También se usan en algunos motores de automóvil.
- Medicina: El radioisótopo 192Ir se usa en la radiografía industrial para examinar metales sin dañarlos. También se utiliza en el tratamiento del cáncer, en una técnica llamada braquiterapia, donde se coloca una fuente de radiación cerca del área a tratar.
Usos Científicos
- Estándares de Medida: En 1889, una aleación de platino e iridio se usó para construir el prototipo internacional de metro y kilogramo en París. Aunque la definición del metro cambió, el prototipo de kilogramo sigue siendo el estándar mundial de masa.
- Naves Espaciales: El iridio se ha usado en los generadores de energía de naves espaciales no tripuladas, como el Voyager y el New Horizons. Se eligió por su resistencia y capacidad para funcionar a más de 2000 °C.
- Telescopios de Rayos X: Los espejos de telescopios de rayos X, como el observatorio de rayos X Chandra, están cubiertos con una fina capa de iridio. El iridio es excelente para reflejar los rayos X.
- Física de Partículas: El iridio se usa en la física de partículas para producir antiprotones, una forma de antimateria.
Usos Históricos

- Plumas Estilográficas: Las aleaciones de iridio-osmio se usaron en las puntas de las plumas estilográficas. La famosa pluma Parker 51 usaba una aleación de rutenio e iridio.
- Cañones: Las aleaciones de platino-iridio se usaban en los orificios de ventilación de los cañones para evitar el desgaste.
- Pigmento: El "iridio negro", que es iridio muy finamente dividido, se usaba para dar un color negro intenso a las porcelanas.
Precauciones con el Iridio
El iridio en forma de metal no es peligroso para la salud porque no reacciona fácilmente con los tejidos del cuerpo. En el cuerpo humano solo hay una cantidad muy pequeña de iridio.
Sin embargo, el iridio en polvo fino puede ser irritante y puede incendiarse en el aire. Se sabe poco sobre la toxicidad de los compuestos de iridio porque son escasos y se usan en cantidades muy pequeñas. Las sales de iridio que se disuelven en agua podrían ser peligrosas debido a los otros elementos que contienen. Pero la mayoría de los compuestos de iridio no se disuelven, lo que dificulta que el cuerpo los absorba.
El radioisótopo 192Ir es peligroso, como cualquier material radiactivo. Los casos de lesiones relacionados con el iridio han sido por exposición accidental al 192Ir usado en tratamientos médicos. La radiación de alta energía del 192Ir puede aumentar el riesgo de enfermedades. Una exposición externa puede causar quemaduras y otros problemas de salud. Si se ingiere, puede dañar el estómago y los intestinos. Los isótopos 192Ir, 192mIr y 194mIr pueden acumularse en el hígado y causar riesgos para la salud debido a su radiación.
Véase también
 En inglés: Iridium Facts for Kids
En inglés: Iridium Facts for Kids