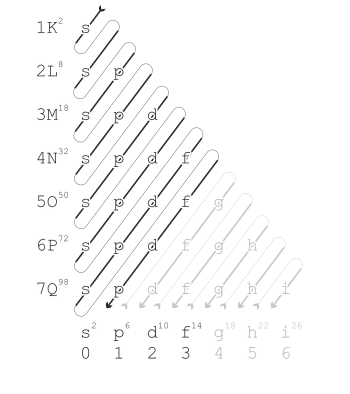Principio de Aufbau para niños
El principio de Aufbau es una regla muy importante en la química que nos ayuda a entender cómo se organizan los electrones dentro de un átomo. Imagina que los electrones son como personas buscando asientos en un edificio con muchos pisos y habitaciones. El principio de Aufbau dice que los electrones siempre intentarán ocupar los asientos (o "orbitales") que tienen la energía más baja primero. La palabra "Aufbau" viene del alemán y significa "construcción", porque este principio nos muestra cómo se "construye" la forma en que los electrones se acomodan.
Este principio fue propuesto por el físico Niels Bohr. Nos da una serie de pasos para saber dónde se ubicará cada electrón en los diferentes espacios alrededor del núcleo de un átomo.
Contenido
¿Cómo se llenan los orbitales?
Los electrones se van colocando en los "orbitales" de un átomo. Un orbital es como una zona o espacio donde es más probable encontrar un electrón. Estos orbitales tienen diferentes niveles de energía.
La Regla de Hund
Cuando hay varios orbitales con la misma energía (como habitaciones idénticas en el mismo piso), los electrones siguen la regla de Hund. Esta regla dice que los electrones primero ocupan cada uno de esos orbitales "solos" antes de que cualquier orbital tenga dos electrones. Es como si en un autobús, cada asiento se ocupara por una persona antes de que dos personas se sienten juntas en el mismo asiento.
El Principio de Exclusión de Pauli
Además, el principio de exclusión de Pauli nos dice que no puede haber dos electrones en el mismo átomo que tengan exactamente las mismas características o "dirección" en el mismo orbital. Si dos electrones comparten un orbital, deben tener "giros" opuestos, como si uno girara hacia la derecha y el otro hacia la izquierda.
Orden de llenado de los orbitales
Para entender cómo se llenan los orbitales, seguimos un orden específico, empezando por los de menor energía:
- Primero se llena el orbital 1s. Este puede contener hasta dos electrones.
- Luego, se llena el orbital 2s, que también puede tener hasta dos electrones.
- Después, vienen los orbitales 2p. Hay tres tipos de orbitales 2p, y cada uno puede tener dos electrones, sumando un total de seis electrones para los orbitales 2p. Recuerda la regla de Hund: primero se coloca un electrón en cada uno de los tres orbitales 2p, y luego, si hay más, se empiezan a emparejar.
Y así, el llenado continúa en un orden que puede parecer un poco complicado al principio:
- 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d107p6
El Diagrama de Moeller: La Regla del Serrucho
Para que sea más fácil recordar el orden en que se llenan los orbitales, existe una herramienta visual llamada diagrama de Moeller, también conocida como la regla del serrucho o método de las diagonales.
Para usar este diagrama, solo tienes que seguir la dirección de las flechas, como si estuvieras cortando con un serrucho:
- Empieza por el 1s.
- Luego, sigue la flecha hacia el 2s.
- Después, la flecha te lleva al 2p y luego al 3s.
- Continúa con el 3p y el 4s.
- ¡Atención aquí! El siguiente no es el 4p, sino que la flecha te lleva al 3d, y después al 4p y al 5s.
- Y así sucesivamente, siguiendo siempre las diagonales.
El orden de llenado que nos da este diagrama es: (1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d)
Esta regla es muy útil para saber cómo se distribuyen los electrones en cualquier átomo y entender sus propiedades químicas.
Véase también
 En inglés: Electron shell Facts for Kids
En inglés: Electron shell Facts for Kids