Plutonio para niños
Datos para niños Neptunio ← Plutonio → Americio |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Plutonio, Pu, 94 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Actínidos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | -, 7, f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 244 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Rn] 5f6 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 32, 24, 8, 2 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Blanco plateado | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 135 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,28 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 159 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 187±1 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 6, 5, 4, 3 (óxido anfotérico) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 584,7 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 19816 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 912,5 K (639 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 3505 K (3232 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 333,5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 2,82 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 10,00 Pa a 2.926 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Monoclínica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 35,5 J/(kg·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 6,74 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo elástico | 96 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de cizalladura | 43 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coeficiente de Poisson | 0,21 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 2,260 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del plutonio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El plutonio es un elemento transuránico radiactivo con el símbolo químico Pu y el número atómico 94. Es un metal actínido de color gris plateado que se oscurece al exponerse al aire. Esto ocurre porque forma una capa opaca cuando se oxida.
Este elemento puede presentarse en seis formas diferentes, llamadas alótropos. También tiene cuatro estados de oxidación distintos. El plutonio reacciona con el carbono, los halógenos, el nitrógeno y el silicio. Cuando se expone al aire húmedo, forma óxidos e hidruros. Estos pueden aumentar su volumen hasta un 70% y desprenderse en forma de polvo que puede encenderse por sí solo.
El plutonio es un elemento radiactivo. Puede acumularse en los huesos, lo que hace que su manejo sea peligroso.
El plutonio es el elemento primordial más pesado que existe. Su isótopo más estable, el plutonio-244, tiene una semivida de unos 80 millones de años. Esto permite que se encuentre en cantidades muy pequeñas en la naturaleza. El plutonio se produce principalmente como subproducto de la fisión nuclear en los reactores. Allí, algunos neutrones liberados convierten el uranio-238 en plutonio.
Uno de los isótopos de plutonio más usados es el plutonio-239, con una semivida de 24.100 años. El plutonio-239 y el plutonio-241 son elementos fisibles. Esto significa que el núcleo de sus átomos puede dividirse al ser golpeado por neutrones. Al dividirse, liberan energía, radiación gamma y más neutrones. Estos neutrones pueden iniciar una reacción nuclear en cadena. Esta propiedad se usa en reactores nucleares para generar energía.
El plutonio-238 tiene una semivida de 88 años y emite partículas alfa. Se usa como fuente de calor en generadores termoeléctricos de radioisótopos. Estos generadores proporcionan energía a algunas sondas espaciales. El plutonio-240 tiene una alta tasa de fisión espontánea. Esto aumenta el flujo de neutrones en cualquier muestra donde se encuentre. La presencia de plutonio-240 afecta su uso como combustible nuclear. Los isótopos de plutonio son costosos y difíciles de separar. Por eso, suelen fabricarse en reactores especiales.
El plutonio fue creado por primera vez en 1940. Un equipo liderado por Glenn T. Seaborg y Edwin McMillan lo logró. Bombardearon uranio-238 con deuterio en la Universidad de California, Berkeley. Más tarde, se encontraron pequeñas cantidades de plutonio en la naturaleza. La producción de plutonio fue clave en el Proyecto Manhattan durante la Segunda Guerra Mundial. Este proyecto desarrolló las primeras bombas que usaban la energía del átomo. La primera prueba de este tipo de bomba, llamada "Trinity" (julio de 1945), y la bomba "Fat Man" (lanzada en Nagasaki, Japón en agosto de 1945) contenían plutonio-239.
Después de la guerra, se realizaron estudios sobre la radiación del plutonio. También hubo accidentes, algunos con consecuencias graves. La gestión de los residuos de plutonio de las centrales nucleares y el desmantelamiento de las armas nucleares son temas importantes. Otras fuentes de plutonio en el ambiente son resultado de pruebas nucleares pasadas.
Contenido
Historia del Plutonio
¿Cómo se Descubrió el Plutonio?

En 1934, Enrico Fermi y su equipo en la Universidad de Roma pensaron haber descubierto el elemento 94. Fermi lo llamó hesperio. Sin embargo, en ese momento no se sabía que la fisión nuclear existía. La muestra que tenían era una mezcla de otros elementos.
El plutonio, específicamente el plutonio-238, fue producido y aislado por primera vez el 14 de diciembre de 1940. Fue identificado químicamente el 23 de febrero de 1941. Los científicos Glenn T. Seaborg, Edwin M. McMillan, J. W. Kennedy y A. C. Wahl lo lograron. Bombardearon uranio con deuterio en un ciclotrón en la Universidad de California, Berkeley.
El equipo preparó un informe sobre su descubrimiento en marzo de 1941. Pero lo retiraron antes de publicarlo. Esto se debió a que se dieron cuenta de que un isótopo de este nuevo elemento, el plutonio-239, podía usarse para liberar mucha energía. La publicación se retrasó hasta después de la Segunda Guerra Mundial por razones de seguridad.
Edwin McMillan había nombrado al elemento anterior, el neptunio, por el planeta Neptuno. Sugirió que el elemento 94, el siguiente, se llamara como el siguiente planeta, Plutón. Seaborg pensó en "plutio" pero prefirió "plutonio". Eligió las letras "Pu" como un pequeño chiste, y fueron aceptadas en la tabla periódica.
Primeros Estudios del Plutonio
Después de los primeros estudios, se vio que el plutonio tenía una química similar a la del uranio. Las investigaciones continuaron en el Laboratorio Metalúrgico de la Universidad de Chicago. El 18 de agosto de 1942, se aisló y midió por primera vez una cantidad muy pequeña de plutonio. Se produjeron unos 50 miligramos de plutonio-239, pero solo se aisló 1 miligramo. Esto permitió a los científicos determinar la masa del nuevo elemento.
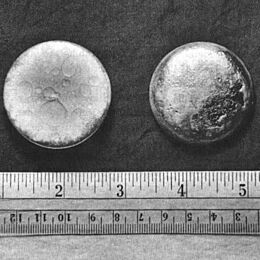
En noviembre de 1943, se obtuvo la primera muestra de plutonio metálico. Se redujeron algunos trifluoruros de plutonio para crear pequeñas perlas metálicas. Fue la primera vez que se pudo ver un elemento creado por el ser humano a simple vista.
También se estudiaron las propiedades del plutonio-239. Los investigadores descubrieron que, al ser golpeado por un neutrón, un átomo de plutonio se divide. Este proceso, llamado fisión, libera más neutrones y energía. Estos neutrones pueden golpear otros átomos de plutonio-239, creando una rápida reacción nuclear en cadena.
Producción durante el Proyecto Manhattan
Durante la Segunda Guerra Mundial, el Gobierno federal de los Estados Unidos creó el Proyecto Manhattan. Este proyecto tenía como objetivo desarrollar la energía atómica. Los principales centros de investigación y producción fueron Hanford Site, Oak Ridge, Tennessee, y el Laboratorio Nacional de Los Álamos.

El primer reactor que produjo plutonio-239 fue el reactor de Grafito X-10. Comenzó a funcionar en 1943 en Oak Ridge. El 5 de abril de 1944, Emilio Segrè recibió la primera muestra de plutonio producido en un reactor.
El Plutonio en la Historia
La primera prueba de una bomba atómica, llamada Trinity, se realizó el 16 de julio de 1945. Contenía plutonio como material principal. En esta bomba, se usaron explosivos para comprimir una esfera de plutonio. Esto ayudó a que se iniciara una reacción en cadena y una gran explosión. La bomba completa pesaba más de 4 toneladas, aunque solo usaba 6,2 kilogramos de plutonio. La explosión fue muy potente.
Un diseño similar se usó en la bomba "Fat Man", lanzada sobre Nagasaki, Japón, el 9 de agosto de 1945. Esta bomba causó una gran destrucción. La existencia del plutonio se hizo pública solo después de que se anunciaran las primeras bombas atómicas.
Uso y Almacenamiento en la Era Moderna
Después de la Guerra Fría, se acumularon grandes cantidades de plutonio. Los reactores en Estados Unidos y otros países producían muchas toneladas. Cada año, se siguen produciendo unas 20 toneladas de plutonio como subproducto de la energía nuclear. Se estima que hay miles de toneladas de plutonio almacenadas en el mundo.
Características del Plutonio
El plutonio, como la mayoría de los metales, es brillante y plateado al principio. Se parece al níquel. Pero se oxida rápidamente y se vuelve gris opaco, o a veces amarillo o verde oliva. A temperatura ambiente, el plutonio está en su forma α (alfa). Esta forma es dura y frágil, como el hierro fundido gris. Sin embargo, si se mezcla con otros metales, puede volverse más blando y fácil de trabajar. A diferencia de la mayoría de los metales, no conduce bien el calor ni la electricidad. Tiene un punto de fusión bajo (640 °C) y un punto de ebullición muy alto (3228 °C).
La desintegración radiactiva más común del plutonio es la desintegración alfa. En este proceso, se libera un núcleo de helio con mucha energía. Una pieza de 5 kg de 239Pu produce calor al desintegrarse. Este calor hace que la pieza se sienta caliente al tacto.
La resistividad mide cuánto se opone un material al paso de la corriente eléctrica. La resistividad del plutonio a temperatura ambiente es muy alta para un metal. Se vuelve aún más alta a temperaturas más bajas, lo cual es inusual.
El plutonio se "fatiga" con el tiempo debido a su propia radiación. Esto significa que la estructura ordenada de sus átomos se altera. Sin embargo, si la temperatura sube, el material puede "curarse" un poco.
A diferencia de la mayoría de los materiales, el plutonio se vuelve más denso cuando se derrite. Su densidad aumenta un 2,5%. El plutonio líquido tiene una viscosidad y tensión superficial muy altas.
Formas del Plutonio (Alótropos)
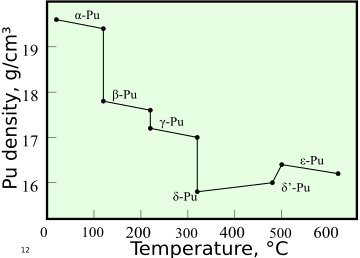
El plutonio tiene seis formas diferentes, llamadas alótropos. Puede formar una séptima forma (zeta, ζ) a altas temperaturas y presiones específicas. Estas formas tienen energías internas muy parecidas. Sin embargo, sus densidades y estructuras cristalinas son muy diferentes. Esto hace que el plutonio sea muy sensible a los cambios de temperatura, presión o composición química. Puede cambiar drásticamente de volumen al pasar de una forma a otra. Las densidades de los alótropos varían de 16,00 g/cm³ a 19,86 g/cm³.
La existencia de tantos alótropos hace que trabajar con plutonio sea difícil. Por ejemplo, la forma alfa es la más común a temperatura ambiente. Es frágil y resistente. Pero a temperaturas un poco más altas, cambia a la forma beta, que es plástica y maleable. La forma delta es estable a temperatura ambiente si se mezcla con galio, aluminio o cerio. Esta forma es más fácil de trabajar y se puede soldar.
¿Cómo Funciona la Fisión Nuclear del Plutonio?
El plutonio es un metal radiactivo actínido. Su isótopo plutonio-239 es uno de los tres isótopos principales que pueden dividirse (fisibles). Los otros dos son el uranio-233 y el uranio-235. El plutonio-241 también es muy fisible. Para que un isótopo sea fisible, el núcleo atómico debe poder romperse cuando es golpeado por un neutrón lento. Al romperse, debe liberar suficientes neutrones adicionales para mantener una reacción en cadena nuclear.
El plutonio-239 puro puede iniciar una reacción en cadena si hay suficiente cantidad y tiene la forma adecuada. Durante la fisión, una parte de la energía que mantiene unido el núcleo se libera. Esta energía se convierte en calor. La fisión de un kilogramo de plutonio-239 puede producir una gran cantidad de energía. Esta energía es lo que hace que el plutonio-239 sea útil en reactores para generar electricidad.
La presencia del isótopo plutonio-240 en una muestra limita su uso. El plutonio-240 tiene una alta tasa de fisión espontánea. Esto aumenta los niveles de neutrones de fondo. El plutonio se clasifica según el porcentaje de plutonio-240 que contiene. El plutonio con menos del 7% de plutonio-240 se considera de alta pureza.
Isótopos y su Creación
Se han identificado 20 isótopos radiactivos de plutonio. Los más duraderos son el plutonio-244 (80,8 millones de años de vida media), el plutonio-242 (373.300 años) y el plutonio-239 (24.110 años). Los demás isótopos tienen una vida media más corta.
Los isótopos de plutonio van desde el número de masa 228 hasta el 247. Los isótopos con un número de masa menor que el plutonio-244 se desintegran principalmente por fisión espontánea y emisión alfa. Esto forma uranio o neptunio. Los isótopos con un número de masa mayor que el plutonio-244 se desintegran principalmente por emisión beta, formando americio.
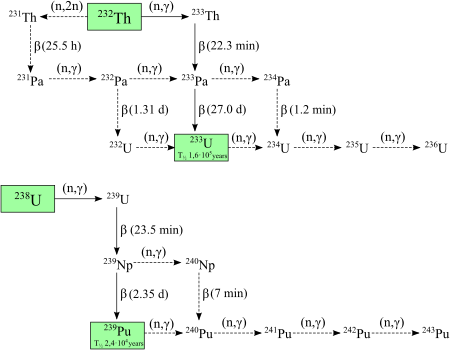
El plutonio-238 y el plutonio-239 son los isótopos más producidos. El plutonio-239 se crea a partir de uranio (U) y neutrones (n). Los neutrones de la fisión del uranio-235 son capturados por el uranio-238. Esto forma uranio-239, que luego se convierte en neptunio-239 y finalmente en plutonio-239.
El plutonio-238 se crea bombardeando uranio-238 con deuteróns (D). Esto produce neptunio-238, que se desintegra en plutonio-238.
Calor y Fusión del Plutonio
Los isótopos de plutonio se desintegran de forma radiactiva, lo que produce calor. Diferentes isótopos generan distintas cantidades de calor por masa. En piezas grandes de plutonio, si el calor no se disipa bien, el material puede calentarse mucho. Todos los isótopos emiten radiación gamma débil al desintegrarse.
| Isótopo | Modo de desintegración | vida media (años) | calor de desintegración (W/kg) | neutrones (1/(g-s)) | Comentario |
|---|---|---|---|---|---|
| 238Pu | alfa a 234U. | 87.74 | 560 | 2600 | Produce mucho calor. Incluso en pequeñas cantidades, puede calentarse significativamente. Se usa en generador termoeléctrico radioisótopico. |
| 239Pu | alfa a 235U. | 24100 | 1.9 | 0.022 | El isótopo fisible más importante. |
| 240Pu | alfa a 236U, fisión espontánea | 6560 | 6.8 | 910 | Es la principal impureza en el 239Pu. Su alta fisión espontánea dificulta algunos usos. |
| 241Pu | beta-menos, a 241Am | 14.4 | 4.2 | 0.049 | Se desintegra en americio-241. Su acumulación puede ser un riesgo en muestras antiguas. |
| 242Pu | alfa a 238U. | 376000 | 0.1 | 1700 |
Compuestos y Reacciones Químicas
A temperatura ambiente, el plutonio puro es plateado. Pero se oxida y se deslustra. El elemento tiene cuatro estados de oxidación comunes en soluciones líquidas y uno raro. El color de las soluciones de plutonio depende de su estado de oxidación y del tipo de anión ácido.
El plutonio metálico se obtiene al hacer reaccionar tetrafluoruro de plutonio con bario, calcio o litio a 1200 °C. Es atacado por ácidos, oxígeno y vapor, pero no por álcalis. Se disuelve fácilmente en ácido clorhídrico, hidroico y ácido perclórico. El metal fundido debe guardarse en un vacío o en una atmósfera inerte para evitar que reaccione con el aire. A 135 °C, el metal puede encenderse en el aire.
El plutonio es un metal muy reactivo. En aire húmedo o argón húmedo, se oxida rápidamente. Esto produce una mezcla de óxidos e hidruros. Si el metal se expone mucho tiempo a poco vapor de agua, se forma una capa de polvo de PuO2. También se forma hidruro de plutonio.
El plutonio reacciona muy rápido con el hidrógeno puro, formando hidruro de plutonio. También reacciona fácilmente con el oxígeno, formando PuO y PuO2. El óxido de plutonio ocupa un 40% más de volumen que el metal. El metal reacciona con los halógenos, formando compuestos como PuF3, PuCl3, PuBr3 y PuI3. También se forman oxihaluros como PuOCl. Reacciona con el carbono para formar PuC, con el nitrógeno para formar PuN y con el silicio para formar PuSi2.
El polvo de plutonio, sus hidruros y algunos óxidos pueden encenderse por sí solos a temperatura ambiente. Por eso, deben manejarse en un ambiente seco con gas inerte. El plutonio en grandes piezas solo se enciende si se calienta a más de 400 °C.
Los recipientes para plutonio deben ser muy resistentes. Metales como el tántalo y el tungsteno, junto con óxidos y otros compuestos estables, pueden contenerlo.
¿Dónde se Encuentra el Plutonio?
Se pueden encontrar pequeñas cantidades de plutonio-238, plutonio-239, plutonio-240 y plutonio-244 en la naturaleza. Muy pequeñas cantidades de plutonio-239 se encuentran en algunos minerales de uranio. Esto ocurre porque el uranio-238 a veces se divide de forma espontánea, liberando neutrones. Si uno de estos neutrones golpea otro átomo de uranio-238, se absorbe y se convierte en uranio-239. Este uranio-239 se descompone en neptunio-239, y luego en plutonio-239.
También se han encontrado cantidades muy pequeñas de plutonio-238 en muestras de uranio natural. Esto se debe a una desintegración muy rara del uranio-238.
Debido a su larga vida media, se pensó que el plutonio-244 existía de forma natural desde el origen del sistema solar. Se han encontrado pruebas de su existencia pasada en meteoritos.
Usos del Plutonio
Plutonio en la Generación de Energía

El isótopo plutonio-239 es muy importante en la energía nuclear porque es fácil de dividir. Al rodear el plutonio con una capa densa, se necesita menos cantidad para iniciar una reacción. Esto reduce la cantidad de plutonio necesaria para la fisión.
Las bombas que usaban plutonio durante el Proyecto Manhattan comprimían el plutonio con explosivos. Esto aumentaba su densidad y ayudaba a iniciar la reacción. De esta manera, solo se necesitaban 6,2 kg de plutonio para una explosión muy potente.
Precauciones con el Plutonio
¿Por Qué es Peligroso el Plutonio?
El plutonio es un elemento muy peligroso, no por sus propiedades químicas, sino por su radiación ionizante. Los isótopos y compuestos de plutonio son radiactivos y pueden acumularse en los huesos. Se han producido contaminaciones por óxido de plutonio en accidentes radiactivos.
Cuando el plutonio se desintegra, libera tres tipos de radiación: alfa, beta y gamma. La radiación alfa es muy dañina debido a su alta masa. Aunque solo viaja distancias cortas, si entra en los pulmones, puede causar daños graves. La radiación beta puede penetrar la piel, pero no el cuerpo. La radiación gamma puede atravesar todo el cuerpo. Los tres tipos de radiación son ionizantes, lo que significa que pueden dañar las células. Una exposición prolongada o intensa puede causar problemas de salud graves, como síndrome de irradiación aguda, daño genético y enfermedades. El daño aumenta con la cantidad de exposición.
Riesgo de Reacción en Cadena
Es crucial evitar que el plutonio se junte en cantidades cercanas a su masa crítica. La masa crítica del plutonio es menor que la del uranio-235. Si se alcanza la masa crítica, el plutonio emite cantidades peligrosas de neutrones y rayos gamma. El plutonio en estado líquido tiene más probabilidades de formar una masa crítica que en estado sólido.
¿Es Inflamable el Plutonio?
El plutonio metálico se enciende fácilmente, sobre todo si está en polvo fino. En un ambiente húmedo, el plutonio forma hidruros en su superficie que pueden encenderse por sí solos a temperatura ambiente. Cuando el plutonio se oxida, puede aumentar su volumen hasta un 70%, lo que podría romper su contenedor. La radiactividad del material en llamas es un peligro adicional. La arena de óxido de magnesio es el mejor material para apagar un fuego de plutonio. Enfría el material y bloquea el oxígeno. Por seguridad, el plutonio debe manipularse y almacenarse en un ambiente seco con gas inerte.
Más Información
- Ciclo del combustible nuclear
- Energía nuclear
- Física nuclear
- Ingeniería nuclear
- Efectos biológicos de la radiación
Véase también
 En inglés: Plutonium Facts for Kids
En inglés: Plutonium Facts for Kids