Americio para niños
Datos para niños Plutonio ← Americio → Curio |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
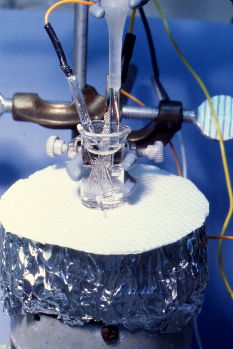
 Un botón de americio bajo el microscopio.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Americio, Am, 95 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Actínidos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | -, 7, f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 243 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Rn] 5f7 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 32, 25, 8, 2 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Metal gris | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 175 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,3 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 173 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 180±6 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 7, 6,5,4,3, 2 (óxido anfotérico) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 578 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 13,670 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 1449 K (1176 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 2880 K (2607 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 14,39 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Hexagonal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | 2,2 × 106 m-1 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 10 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del americio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El americio es un elemento químico especial que no se encuentra de forma natural en la Tierra. Fue creado por científicos y tiene el número atómico 95 en la tabla periódica de los elementos. Pertenece a un grupo llamado actínidos. Su símbolo es Am.
Todos los tipos de americio son radiactivos, lo que significa que emiten energía. Su nombre viene de "América", de manera similar a cómo el europio fue nombrado por Europa.
El americio fue creado por primera vez en 1944 por un equipo de científicos liderado por Glenn T. Seaborg en la Universidad de Chicago, en Estados Unidos. Aunque es el tercer elemento en la serie de elementos creados después del uranio (llamados transuránicos), fue descubierto en cuarto lugar. Su descubrimiento se mantuvo en secreto por un tiempo y se anunció al público en noviembre de 1945.
La mayor parte del americio se produce en reactores nucleares. Se forma cuando el uranio o el plutonio son bombardeados con pequeñas partículas llamadas neutrones. Por ejemplo, una tonelada de combustible nuclear usado puede contener unos 100 gramos de americio.
Este elemento se usa en algunas cosas importantes, como los detectores de humo que tenemos en casa. También se utiliza en fuentes de neutrones y en aparatos de medición para la industria. Se han pensado otros usos, como en baterías especiales o como combustible para naves espaciales, pero estos aún son difíciles de lograr por lo caro y escaso que es.
El americio es un metal de color gris plateado. Sus tipos más comunes son el americio-241 y el americio-243. En los compuestos químicos, el americio suele tener un estado de oxidación de +3. Con el tiempo, el americio puede cambiar un poco sus propiedades debido a la energía que emite.
Contenido
¿Cómo se Descubrió el Americio?
El americio fue creado por primera vez por los científicos Glenn T. Seaborg, Leon O. Morgan, Ralph A. James y Albert Ghiorso en 1944. Esto ocurrió en el Laboratorio de Metalurgia de la Universidad de Chicago.
El equipo logró crear el americio-241 a partir de plutonio-239. Lo hicieron bombardeando el plutonio con neutrones en un reactor nuclear. Este proceso transformó el plutonio en americio. Glenn T. Seaborg obtuvo una patente por este descubrimiento.
Propiedades y Características del Americio
El americio puro es un metal brillante de color blanco plateado. Es más plateado y más fácil de moldear que otros elementos como el plutonio o el uranio.
El americio-241 emite una cantidad considerable de rayos gamma, que son un tipo de energía. Por eso, es importante manejarlo con mucho cuidado. Una característica interesante del americio es que puede ser fisionable, lo que significa que su núcleo puede dividirse.
Isótopos del Americio: ¿Qué Son?
Isótopos de americio Los isótopos son diferentes versiones de un mismo elemento. El americio tiene 19 isótopos radiactivos conocidos. Los más estables son el americio-243, que dura unos 7370 años, y el americio-241, que dura unos 472,7 años. Los demás isótopos duran mucho menos tiempo.
El americio también tiene ocho "isómeros nucleares", que son como versiones especiales de sus isótopos. El más estable de estos es el americio-242m, que dura 141 años.
¿Dónde se Encuentra el Americio?
Como el americio es un elemento creado por el ser humano y sus isótopos más duraderos tienen vidas medias de cientos o miles de años, cualquier americio que hubiera existido desde la formación de la Tierra ya se habría descompuesto.
Hoy en día, el americio se encuentra principalmente en lugares donde se realizaron pruebas de armas nucleares entre 1945 y 1980, o en sitios de accidentes nucleares, como el de Chernóbil. Por ejemplo, se encontró americio en los restos de la primera prueba de una bomba de hidrógeno en 1952. También se detectó en el suelo cerca de Alamogordo, Nuevo México, después de la primera prueba de una bomba nuclear en 1945.
En otras áreas, la cantidad de americio en el suelo es muy pequeña. El americio en el aire no se disuelve fácilmente y tiende a pegarse a las partículas del suelo.
El americio se produce principalmente en laboratorios para investigaciones. El combustible nuclear usado contiene americio, y como su radiactividad dura mucho tiempo, los científicos buscan formas de transformarlo en elementos que duren menos. Este proceso se llama transmutación nuclear y aún se está investigando.
El americio también ha sido detectado en una estrella muy especial llamada la Estrella de Przybylski.
Usos del Americio en la Vida Diaria
El americio se puede producir en cantidades de varios kilogramos y tiene algunos usos importantes. El americio-241, por ejemplo, se ha usado como una fuente portátil de rayos gamma para hacer radiografías. El isótopo americio-242 se ha propuesto para cohetes avanzados, pero es muy costoso de producir en grandes cantidades.
Americio en Detectores de Humo
Uno de los usos más comunes del americio es en los detectores de humo que tenemos en casa. Estos detectores contienen una pequeña cantidad de americio-241, aproximadamente 0,2 miligramos.
¿Cómo funciona? Dentro del detector hay una cámara donde el americio emite pequeñas partículas alfa. Estas partículas hacen que el aire dentro de la cámara se vuelva conductor de electricidad. Si entra humo en la cámara, las partículas de humo reducen la capacidad del aire para conducir electricidad, lo que interrumpe un circuito y hace que la alarma suene.
Es importante saber que la cantidad de americio en estos detectores es muy pequeña y no representa un peligro para la salud de las personas en el hogar. Aunque algunos detectores antiguos ya no se venden, tener uno instalado no es ilegal. Estos detectores fueron retirados del mercado porque su manejo como residuo era más complicado y caro de lo normal.
La Química del Americio
El americio suele presentarse con un estado de oxidación de +3 en sus compuestos. Es más difícil hacer que el americio cambie a un estado de oxidación de +4 en soluciones de agua, a diferencia de lo que ocurre con el plutonio.
Los científicos investigan cómo reducir el riesgo de la radiación del americio o cómo usarlo de forma segura como combustible nuclear.
A diferencia del uranio, el americio no forma fácilmente dióxido de americio (AmO2). Esto se debe a que es difícil oxidarlo más allá de +3 cuando está en soluciones acuosas. En el ambiente, el americio puede formar compuestos complejos al unirse con carbono y oxígeno. Algunos ejemplos de estos compuestos son:
- AmO2(OH)+1
- AmO2(OH)2+2
- AmO2CO3+1
- AmO2(CO3)2-1
- AmO2(CO3)3-3
Véase también
 En inglés: Americium Facts for Kids
En inglés: Americium Facts for Kids