Carbonato de sodio para niños
Datos para niños
Carbonato de sodio |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Trioxocarbonato(IV) de Sodio | ||
| General | ||
| Otros nombres | Barrilla natrón sosa Solvay ceniza de soda E-500 sosa calcinada soda ash cristales de soda xoda lavada carbonato sódico anhidro |
|
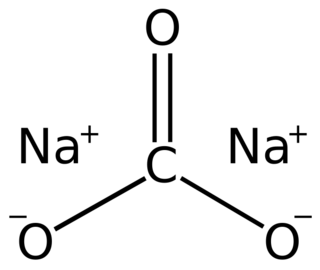
| Fórmula estructural |  |
|
| Fórmula molecular | Na2CO3 | |
| Identificadores | ||
| Número CAS | 497-19-8 | |
| Número RTECS | VZ4050000 | |
| ChEBI | 29377 | |
| ChEMBL | CHEMBL186314 | |
| ChemSpider | 9916 | |
| DrugBank | DB09460 | |
| PubChem | 516885 10340, 516885 | |
| UNII | 45P3261C7T | |
|
InChI
InChI=InChI=1S/CH2O3.2Na/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2
Key: CDBYLPFSWZWCQE-UHFFFAOYSA-L |
||
| Propiedades físicas | ||
| Apariencia | Sólido blanco | |
| Densidad | 2540 kg/m³; 2,54 g/cm³ | |
| Masa molar | 105,9885 g/mol | |
| Punto de fusión | 1124 K (851 °C) | |
| Punto de ebullición | 1873 K (1600 °C) | |
| Propiedades químicas | ||
| Acidez | 10,33 pKa | |
| Solubilidad en agua | 30.7 g por cada 100 g de agua (25 °C) | |
| Termoquímica | ||
| ΔfH0líquido | -1102 kJ/mol | |
| ΔfH0sólido | -1131 kJ/mol | |
| S0sólido | 135 J·mol–1·K–1 | |
| Peligrosidad | ||
| SGA |  |
|
| NFPA 704 |
0
1
1
|
|
| Frases R | R36 | |
| Frases S | (S2), S22, S26 | |
| Frases H | H319 | |
| Frases P | (P260), (P305 + P351 + P338) | |
| Riesgos | ||
| Ingestión | Causa irritación y diarrea sangrante. | |
| Inhalación | Dañina, deben evitarse especialmente exposiciones prolongadas. | |
| Piel | Irritaciones y posiblemente quemaduras. | |
| Ojos | Irritación grave, posiblemente con heridas graves. | |
| Compuestos relacionados | ||
| Otros aniones | Bicarbonato de sodio | |
| Otros cationes | Carbonato de litio Carbonato de potasio |
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El carbonato de sodio o carbonato sódico es una sal de color blanco y algo transparente. Su fórmula química es Na2CO3. Se usa en la fabricación de jabón, vidrio y tintes, entre otras cosas.
También se le conoce con otros nombres como barrilla, natrón, sosa Solvay o ceniza de soda. Es importante no confundirlo con la sosa cáustica, que es otra sustancia química diferente.
El carbonato de sodio es una de las sustancias alcalinas más comunes. Se ha usado desde hace mucho tiempo. Absorbe bien la humedad y se disuelve fácilmente en agua. Cuando se disuelve, forma una solución que es un poco alcalina.
Una de sus aplicaciones más importantes es en la fabricación de vidrio. Casi la mitad de todo el carbonato de sodio que se produce se usa para esto. Ayuda a que la sílice (un ingrediente del vidrio) se derrita más fácilmente. También se usa para limpiar.
Podemos encontrar carbonato de sodio en la naturaleza o producirlo de forma artificial.
Contenido
¿Cómo se produce el carbonato de sodio?
El carbonato de sodio se puede obtener de la naturaleza o fabricarse en fábricas.
Producción natural de carbonato de sodio
El carbonato de sodio se encuentra en la naturaleza en lugares secos. Se forma en depósitos de minerales cuando los lagos estacionales se secan.
- El mineral llamado trona es una fuente importante. Se extrae en lugares como Wyoming en Estados Unidos y Turquía.
- También se obtiene de algunos lagos alcalinos, como el lago Magadi en Kenia. En estos lagos, el agua salada caliente repone continuamente la sal.
- La forma mineral pura de carbonato de sodio, llamada natrita, es poco común.
- Incluso se ha encontrado carbonato de sodio en el volcán Ol Doinyo Lengai en Tanzania.
Producción artificial de carbonato de sodio
A lo largo de la historia, se han desarrollado diferentes métodos para fabricar carbonato de sodio.
Método de la barrilla y las algas
Antiguamente, en Europa, se obtenía carbonato de sodio de plantas que toleran la sal (como las del género Salicornia) y de algas marinas.
- Estas plantas o algas se recolectaban, se secaban y se quemaban.
- Las cenizas se lavaban con agua para obtener una solución alcalina.
- Luego, esta solución se hervía hasta que se secaba, dejando un producto llamado "barrilla".
- La cantidad de carbonato de sodio en esta "barrilla" variaba mucho, desde un 2-3% en las algas hasta un 30% en las mejores plantas de España.
Proceso Leblanc
En 1791, el químico francés Nicolás Leblanc inventó un proceso para producir carbonato de sodio. Este método usaba cloruro de sodio (sal común), ácido sulfúrico, caliza y carbón.
- Primero, la sal común reaccionaba con ácido sulfúrico para formar sulfato de sodio y cloruro de hidrógeno.
- Luego, el sulfato de sodio se mezclaba con caliza y carbón y se calentaba. Esto producía carbonato de sodio y otros subproductos.
- Este proceso generaba contaminación del aire por el cloruro de hidrógeno y problemas con los residuos. A pesar de esto, fue el método principal hasta finales del siglo XIX.
Proceso Solvay
En 1861, el químico belga Ernest Solvay desarrolló un método mejor. Este proceso es más económico y contamina menos.
- Utiliza cloruro de sodio (sal), amoníaco y carbonato de calcio (piedra caliza).
- Primero, estos ingredientes reaccionan para formar bicarbonato de sodio y cloruro de amonio.
- Luego, el bicarbonato de sodio se calienta para convertirlo en carbonato de sodio, liberando agua y dióxido de carbono.
- El amoníaco se recupera y se reutiliza, lo que hace que el proceso sea más eficiente.
- El único desecho es el cloruro de calcio.
- El proceso Solvay se hizo muy popular y reemplazó al método Leblanc.
Proceso de Hou
Este proceso fue creado por el químico chino Hou Debang en la década de 1930. Es una mejora del proceso Solvay.
- En este método, el dióxido de carbono se bombea a una solución de sal y amoníaco para producir bicarbonato de sodio.
- El bicarbonato de sodio se calienta para obtener carbonato de sodio puro.
- Una ventaja de este proceso es que el cloruro de amonio que se produce como subproducto se puede vender como fertilizante. Esto lo hace más eficiente y con menos residuos.
¿Para qué se usa el carbonato de sodio?
El carbonato de sodio tiene muchos usos importantes en la industria y en el hogar.
- Fabricación de vidrio: Es su uso más grande, ayuda a fundir la sílice.
- Detergentes: Es esencial en la fórmula de los detergentes para que funcionen bien durante el lavado.
- Limpieza: Se usa en productos de limpieza, especialmente para baños e inodoros.
- Regulación del pH: Ayuda a controlar la acidez o alcalinidad de soluciones en la industria, como en el tratamiento de aguas.
- Otras industrias: Se usa en la fabricación de cerámica, jabones, suavizantes de aguas duras, en la refinación de petróleos, producción de aluminio, en la industria textil, en la fabricación de pulpa y papel.
- Metalurgia: Se usa en el procesamiento de metales y para reducir el contenido de azufre y fósforo en el acero.
- Productos químicos: Se usa para producir bicarbonato de sodio, nitrato de sodio y otros productos químicos.
Propiedades del carbonato de sodio
El carbonato de sodio es un sólido blanco. Se disuelve fácilmente en agua.
- Su densidad es de 2.54 gramos por centímetro cúbico.
- Se funde a 851 °C y hierve a 1600 °C.
- La Dureza Mohs del carbonato de sodio monohidratado es de 1.3, lo que significa que es un mineral bastante blando.
Carbonato de sodio como mineral natural
El carbonato de sodio se encuentra en la naturaleza en forma de varios minerales.
- El natrón es un mineral que contiene carbonato de sodio. Se ha extraído de lagos secos en Egipto desde la antigüedad. Se usaba para preparar momias y en la fabricación temprana de vidrio.
- La natrita es la forma mineral pura y sin agua del carbonato de sodio, pero es rara.
- También se ha encontrado en algunas rocas especiales llamadas pegmatitas en lugares como la península de Kola en Rusia.
- Fuera de la Tierra, se han identificado depósitos de carbonato de sodio en el planeta enano Ceres.
Véase también
 En inglés: Sodium carbonate Facts for Kids
En inglés: Sodium carbonate Facts for Kids
- Bicarbonato de sodio
- Cloruro de sodio
- Natrón
- Salicornia
- Sarcocornia