Francio para niños
El francio es un elemento químico con el símbolo Fr y el número atómico 87. Es un metal alcalino muy radiactivo y reactivo. Esto significa que se descompone rápidamente en otros elementos como el astato, el radio y el radón. El francio tiene la electronegatividad más baja que se conoce y es el segundo elemento menos común en la naturaleza.
Como todos los metales alcalinos, el francio tiene solo un electrón en su capa más externa. Esto lo hace muy propenso a reaccionar con otros elementos.
Datos para niños Radón ← Francio → Radio |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Francio, Fr, 87 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Metales alcalinos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 1, 7, s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 223 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Rn] 7s1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Mohs | Sin datos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 32, 18, 8, 1 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Metálico (gris amarillento) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | Sin datos pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 0,7 (Pauling) 0,9 (Allred y Rochow) (escala de Pauling) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 270 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio iónico | 194 pm (Fr+, hexacoordinado) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 260 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de van der Waals | 348 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óxido | Base fuerte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 380 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Líquido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 1870 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 300 K (27 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 950 K (677 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 65 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 2 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | Sin datos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Cúbica centrada en el cuerpo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | Sin datos J/(kg·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | 3 × 106/m O S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 15 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | Sin datos m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del francio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Marguerite Perey descubrió este elemento en 1939. El francio fue el último elemento encontrado en la naturaleza antes de que los científicos pudieran crearlo en laboratorios. En la naturaleza, el francio es muy raro. Se encuentra en pequeñas cantidades en minerales de uranio y torio. Allí, el isótopo 223Fr se forma y se descompone continuamente.
Se cree que en la corteza terrestre no hay más de 30 gramos de 223Fr en un momento dado. Los demás isótopos de francio son creados por el ser humano. La mayor cantidad de francio que se ha logrado obtener fue un grupo de 10 mil millones de átomos de 210Fr. Esto ocurrió en 1996 en Stony Brook, donde se sintetizó como un gas muy frío.
Contenido
¿Cómo es el Francio? Propiedades Físicas y Químicas
El francio es menos estable que casi cualquier otro elemento más ligero que el nobelio (elemento 102). Su isótopo más estable, el 223Fr, tiene una vida media de menos de 22 minutos. Esto significa que la mitad de una muestra de 223Fr se desintegra en menos de 22 minutos.
Las propiedades químicas del francio son muy parecidas a las del cesio. Es un metal alcalino muy pesado con un solo electrón en su capa exterior. El francio tiene la electronegatividad más baja de todos los elementos conocidos, con un valor de 0,7 en la escala de Pauling.
El francio se mezcla fácilmente con muchas sales de cesio. Por ejemplo, puede formar perclorato de francio junto con perclorato de cesio. Esta característica se usa para separar el francio de otras sustancias. Casi todas las sales de francio se disuelven en agua.
¿Para qué se usa el Francio? Aplicaciones
El francio no tiene usos comerciales. Esto se debe a que es muy escaso y se descompone muy rápido. Solo se ha utilizado en investigaciones científicas. Estas investigaciones se centran en la biología y en el estudio de la estructura atómica.
En un momento se pensó que el francio podría ayudar a diagnosticar ciertas enfermedades. Sin embargo, esta idea no resultó práctica.
La capacidad de crear francio en el laboratorio, atraparlo y enfriarlo ha permitido estudiarlo con espectroscopia. Estos experimentos han dado información importante sobre los niveles de energía de los átomos y cómo interactúan las partículas subatómicas. Los estudios de la luz que emiten los iones de 210Fr han confirmado que los resultados experimentales coinciden con lo que predice la Teoría Cuántica.
La Historia del Descubrimiento del Francio
Desde 1870, los científicos ya sospechaban que debía existir un metal alcalino más allá del cesio. Lo llamaban provisionalmente eka-cesio. Varios equipos intentaron encontrarlo, y hubo al menos cuatro anuncios falsos de su descubrimiento antes de que fuera realmente hallado.
Intentos Fallidos de Descubrimiento
El químico ruso D. K. Dobroserdov fue el primero en decir que había descubierto el eka-cesio en 1925. Observó una pequeña cantidad de radiactividad en una muestra de potasio y pensó que era el nuevo elemento. Lo llamó russio.
En 1926, los químicos ingleses Gerald J. F. Druce y Frederick H. Loring creyeron ver el eka-cesio al analizar sulfato de manganeso (II) con rayos X. Propusieron el nombre de alcalinio.
En 1930, el profesor Fred Allison de Alabama también afirmó haberlo encontrado. Lo llamó virginio. Sin embargo, en 1934, se demostró que su método no era fiable.
En 1936, el químico rumano Horia Hulubei y su colega francesa Yvette Cauchois analizaron un mineral llamado polucita. Pensaron que las líneas que vieron en sus análisis de rayos X eran del elemento 87. Lo llamaron moldavio. Pero otros científicos dudaron de sus resultados.
El Verdadero Descubrimiento por Marguerite Perey
El eka-cesio fue finalmente descubierto en 1939 por Marguerite Perey. Ella trabajaba en el Instituto Curie de París, Francia. Perey estaba purificando una muestra de 227Ac y notó que se desintegraba de una manera inesperada. Descubrió que esta actividad era causada por un nuevo elemento.
Este nuevo elemento tenía propiedades químicas de un metal alcalino, como el cesio. Esto llevó a Perey a concluir que había encontrado el elemento 87. Al principio, lo llamó actinio K.
En 1946, Perey propuso el nombre de catio, porque pensó que era el catión (ion positivo) más electropositivo. Pero su supervisora, Irène Joliot-Curie, no estuvo de acuerdo. Entonces, Perey sugirió el nombre de francio, en honor a su país. Este nombre fue aceptado oficialmente en 1949. El francio es el último elemento encontrado en la naturaleza en ser descubierto.
¿Dónde se Encuentra el Francio? Abundancia
En la Naturaleza
El isótopo 223Fr se forma cuando el 227Ac se desintegra. Por eso, se puede encontrar en cantidades muy pequeñas en minerales de uranio y torio. En una muestra de uranio, se calcula que hay solo un átomo de francio por cada 1.000.000.000.000.000.000 (un trillón) de átomos de uranio. Después del astato, el francio es el elemento menos abundante en la corteza terrestre.
Francio Creado en Laboratorio
El francio también se puede crear en laboratorios. Un método es la reacción nuclear:
- 197Au + 18O → 210Fr + 5n.
Este proceso, desarrollado por Stony Brook Physics, produce isótopos de francio como el 209, 210 y 211. Estos pueden ser aislados usando una trampa magneto-óptica (MOT). Los científicos de Stony Brook han logrado atrapar más de 300.000 átomos neutros de francio a la vez.
Estos átomos atrapados emiten luz, lo que permitió a los investigadores ver el francio por primera vez. Se ve como una esfera brillante de aproximadamente 1 milímetro de diámetro. Esto ha permitido hacer mediciones muy precisas de la luz que el francio emite y absorbe.
Otros métodos para crear francio incluyen bombardear radio con neutrones o bombardear torio con protones, deuterones o iones de helio. El francio no se ha podido, y probablemente nunca se podrá, sintetizar en cantidades lo suficientemente grandes como para ser pesado en una balanza.
Isótopos del Francio
Se conocen 34 isótopos diferentes de francio, con masas atómicas que van desde 199 hasta 232. El francio también tiene siete isómeros nucleares (formas con la misma cantidad de protones y neutrones, pero con diferente energía).
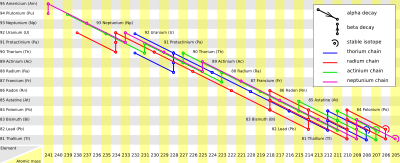
Los únicos isótopos que se encuentran en la naturaleza son el 223Fr y el 221Fr. El 223Fr es mucho más común.
El 223Fr es el isótopo más estable, con una vida media de 21,8 minutos. Es muy poco probable que se encuentre o se cree un isótopo de francio que dure más tiempo. El 223Fr se forma en la cadena de desintegración del actinio, a partir del 227Ac. Luego, el 223Fr se desintegra para formar 223Ra.
El 221Fr tiene una vida media de 4,8 minutos. Se forma en la cadena de desintegración del plutonio, a partir del 225Ac. Después, el 221Fr se desintegra para formar 217At.
El isótopo menos estable es el 215Fr, con una vida media de solo 0,12 microsegundos.
Véase también
 En inglés: Francium Facts for Kids
En inglés: Francium Facts for Kids