Oxígeno para niños
El oxígeno es un elemento químico muy importante con el número atómico 8. Su símbolo es O. El nombre "oxígeno" viene de palabras griegas que significan "productor de ácidos", porque antes se creía que todos los ácidos lo necesitaban.
En condiciones normales, dos átomos de oxígeno se unen para formar el dioxígeno (O2). Este es un gas que no tiene color, olor ni sabor. El dioxígeno es una parte muy grande de nuestra atmósfera y es vital para la vida en la Tierra.
El oxígeno es un no metal muy reactivo. Esto significa que se une fácilmente con casi todos los demás elementos para formar compuestos, como los óxidos. Solo los gases nobles helio y neón no reaccionan con él. El oxígeno es el tercer elemento más abundante en el universo por su masa, después del hidrógeno y el helio. También es el elemento más abundante en la corteza terrestre, formando casi la mitad de su masa.
Como el oxígeno es tan reactivo, no puede quedarse libre en la atmósfera por mucho tiempo. Es repuesto constantemente por la fotosíntesis, un proceso en el que las plantas y otros organismos usan la luz del sol para producir oxígeno a partir del agua. El oxígeno O2 empezó a acumularse en la atmósfera hace unos 2500 millones de años, cuando aparecieron estos organismos. Hoy, el dioxígeno forma el 20.8% del volumen de la atmósfera terrestre.
El oxígeno es el componente principal del agua y también de la masa de los seres vivos. Muchas moléculas importantes en los seres vivos, como las proteínas, los ácidos nucleicos y los carbohidratos, contienen oxígeno. Las cianobacterias, algas y plantas producen oxígeno. Todas las formas de vida complejas lo usan para respirar.
Otra forma de oxígeno, el ozono (O3), nos protege de la radiación ultravioleta en la capa de ozono. Cerca del suelo, el ozono es un contaminante que se forma por el esmog.
Carl Wilhelm Scheele descubrió el oxígeno en 1773, y Joseph Priestley en 1774. Priestley publicó su trabajo primero, por lo que a menudo se le da el crédito. Antoine Lavoisier le dio el nombre de "oxígeno" en 1777. Hoy, el oxígeno se produce para la industria de varias maneras, como separándolo del aire líquido. Se usa en la fabricación de acero, plásticos y textiles, en cohetes, en tratamientos médicos y para ayudar a respirar en aviones y submarinos.
Datos para niños Nitrógeno ← Oxígeno → Flúor |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Oxígeno líquido
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Oxígeno, O, 8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | No metales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 16, 2, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 15.9994 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [He] 2s2 2p4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 6 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Incoloro en estado gaseoso, sólido y líquido de color azul | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 3.44 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 60 (48) pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 73 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de van der Waals | 152 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | −2, −1 (neutro) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 1313.9 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 3388.3 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª energía de ionización | 5300.5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª energía de ionización | 7469.2 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Gas (paramagnético) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 1.429 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 50,35 K (−223 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 90,18 K (−183 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 6.8061 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 0.4384 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volumen molar | 17.36 × 10−3 m3/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | cúbica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 920 J/(kg·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 0.026 74 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 317.5 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del oxígeno | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Contenido
¿Qué es el Oxígeno?
Estructura y Propiedades
El oxígeno que respiramos es un gas incoloro e inodoro llamado dioxígeno (O2). Está formado por dos átomos de oxígeno unidos. Este gas es paramagnético, lo que significa que es atraído por un campo magnético. Por ejemplo, el oxígeno líquido puede ser sostenido por un imán potente.
Existe otra forma de oxígeno llamada ozono (O3). El ozono es muy reactivo y puede ser dañino para los pulmones. Se forma en la parte alta de la atmósfera cuando la luz ultravioleta rompe las moléculas de O2. La capa de ozono nos protege de la radiación solar dañina.
¿Cómo se disuelve el oxígeno en el agua?
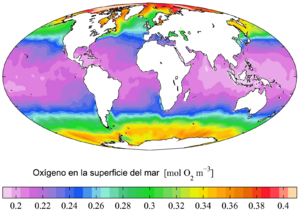
El oxígeno se disuelve en el agua, y es más soluble en agua fría que en agua caliente. Por eso, los océanos polares tienen más vida marina, ya que el agua fría contiene más oxígeno disuelto. La cantidad de oxígeno en el agua puede disminuir por la contaminación hídrica, lo que afecta a la vida acuática.
Isótopos del Oxígeno
El oxígeno que encontramos en la naturaleza tiene tres tipos principales, llamados isótopos: 16O, 17O y 18O. El 16O es el más común, representando casi el 99.762% del oxígeno natural.
Estos isótopos se forman en las estrellas. El 16O se crea al final de la vida de estrellas grandes. El 17O se forma cuando el hidrógeno se convierte en helio dentro de las estrellas. El 18O se produce cuando el 14N captura un núcleo de 4He.
¿Dónde encontramos el Oxígeno?
Abundancia en la Tierra y el Universo
El oxígeno es el elemento más abundante en la biosfera (donde hay vida), el aire, el mar y el suelo de la Tierra. Es el tercer elemento más abundante en el universo, después del hidrógeno y el helio.
En la corteza terrestre, el oxígeno forma el 49.2% de la masa. También es el componente principal de los océanos, constituyendo el 88.8% de su masa total. En la atmósfera terrestre, el oxígeno gaseoso es el segundo componente más abundante, con un 20.8% de su volumen.
La alta concentración de oxígeno en la atmósfera de la Tierra es especial. Otros planetas como Marte y Venus tienen mucho menos oxígeno. Esto se debe al ciclo del oxígeno, un proceso natural que mueve el oxígeno entre la atmósfera, la biosfera y la litosfera. La fotosíntesis es clave en este ciclo, liberando oxígeno al aire, mientras que la respiración y la descomposición lo eliminan.
El Oxígeno y la Vida
Fotosíntesis y Respiración
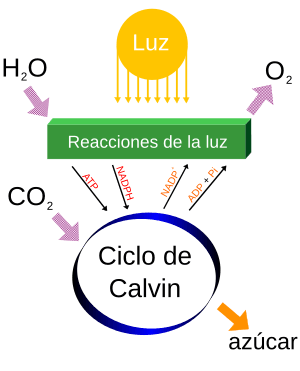
El oxígeno es producido por bacterias, algas y plantas a través de la fotosíntesis. Este proceso usa la luz solar para convertir dióxido de carbono y agua en glucosa (azúcar) y oxígeno.
La fórmula simple de la fotosíntesis es: 6 CO2 + 6 H2O + luz solar → C6H12O6 + 6 O2 (dióxido de carbono + agua + luz solar → glucosa + dioxígeno)
Los organismos que respiran, como los animales, usan el oxígeno en un proceso llamado respiración celular. En este proceso, el oxígeno ayuda a convertir los nutrientes en energía para el cuerpo. La respiración es lo contrario de la fotosíntesis: C6H12O6 + 6 O2 → 6 CO2 + 6 H2O + energía
En los vertebrados, el oxígeno entra a la sangre a través de los pulmones. La hemoglobina en los glóbulos rojos transporta el oxígeno por todo el cuerpo. Un adulto en reposo respira entre 1.8 y 2.4 gramos de oxígeno por minuto.
¿Cómo se acumuló el oxígeno en la atmósfera?
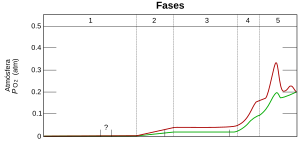
Antes de que existieran las bacterias y arqueobacterias que hacen fotosíntesis, casi no había oxígeno libre en la atmósfera de la Tierra. Empezó a aparecer en grandes cantidades hace unos 2500 millones de años. Al principio, el oxígeno se unía al Hierro disuelto en los océanos. Luego, hace unos 2700 millones de años, los océanos comenzaron a liberar oxígeno al aire.
La aparición de tanto oxígeno libre pudo haber causado la extinción de muchos organismos que no lo necesitaban para vivir. Sin embargo, el oxígeno permitió que evolucionaran organismos más complejos, como las plantas y los animales, que lo usan para obtener mucha más energía.
Historia del Descubrimiento
Primeras Ideas y Experimentos
Hace mucho tiempo, en el S. II a. C., un escritor griego llamado Filón de Bizancio notó que el aire se "consumía" durante la combustión. Siglos después, Leonardo da Vinci también observó que una parte del aire se usaba al quemar cosas y al respirar.
A finales del siglo XVII, Robert Boyle demostró que el aire era necesario para la combustión. Luego, John Mayow descubrió que solo una parte del aire era necesaria, a la que llamó spiritus nitroaereus. Él notó que tanto una vela encendida como un ratón en un recipiente cerrado consumían esta parte del aire.
La Teoría del Flogisto

Durante los siglos XVII y XVIII, muchos científicos produjeron oxígeno, pero no lo reconocieron como un elemento. Esto se debió a la popular teoría del flogisto. Esta teoría decía que los materiales combustibles tenían una sustancia llamada "flogisto" que se liberaba al quemarse. Se pensaba que los objetos se volvían más ligeros al quemarse porque perdían flogisto. Sin embargo, se descubrió que los metales ganaban peso al oxidarse, lo que contradecía esta teoría.
El Descubrimiento Oficial


El farmacéutico sueco Carl Wilhelm Scheele descubrió el oxígeno alrededor de 1772. Lo llamó "aire del fuego". Escribió sobre su descubrimiento, pero su trabajo no se publicó hasta 1777.
Mientras tanto, el 1 de agosto de 1774, el clérigo británico Joseph Priestley también descubrió el gas al calentar óxido de mercurio. Notó que las velas ardían más fuerte y que los ratones vivían más tiempo al respirar este gas. Priestley publicó sus hallazgos en 1775, por lo que a menudo se le considera el descubridor.
El químico francés Antoine Lavoisier también investigó esta sustancia. Priestley le contó sobre su experimento en 1774. Lavoisier realizó experimentos cuidadosos y demostró que el gas era un elemento químico. En 1777, Lavoisier le dio el nombre de "oxígeno".
Avances Posteriores
A finales del siglo XIX, los científicos aprendieron a licuar el aire y a separar sus componentes. El oxígeno fue licuado de forma estable por primera vez en 1883 por los científicos polacos Zygmunt Wróblewski y Karol Olszewski.
En 1895, Carl von Linde y William Hampson desarrollaron métodos para producir oxígeno líquido a gran escala. En 1901, se demostró por primera vez la soldadura de oxiacetileno, que usa oxígeno comprimido para crear una llama muy caliente.
En 1923, el científico estadounidense Robert Goddard creó el primer motor cohete que usaba oxígeno líquido como combustible.
Producción y Usos del Oxígeno
¿Cómo se produce el oxígeno para la industria?
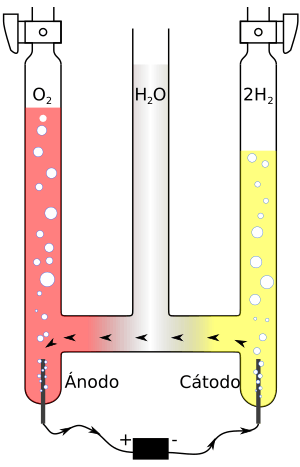
Cada año se producen millones de toneladas de oxígeno para la industria. Los dos métodos principales son:
- Destilación fraccionada del aire líquido: Se enfría el aire hasta que se vuelve líquido, y luego se calienta lentamente. El nitrógeno se evapora primero, dejando el oxígeno líquido.
- Adsorción por oscilación de presión: Se pasa aire a través de materiales especiales (zeolitas) que atrapan el nitrógeno, dejando pasar el oxígeno.
El oxígeno también se puede producir mediante la electrólisis del agua, que usa electricidad para separar el agua en oxígeno e hidrógeno.
El oxígeno líquido se transporta en grandes tanques especiales porque ocupa mucho menos espacio que el gas. Un litro de oxígeno líquido equivale a 840 litros de oxígeno gaseoso.
Usos y Aplicaciones Comunes
El oxígeno tiene muchos usos importantes:
- Producción de acero: El 55% del oxígeno producido se usa para fabricar acero a partir de mena de hierro. El oxígeno ayuda a eliminar impurezas como el azufre y el carbono.
- Industria química: El 25% se usa en la fabricación de plásticos, textiles y otros productos químicos.
- Medicina: Se usa en la oxigenoterapia para pacientes con problemas respiratorios, como neumonía o enfisema pulmonar. También se usa en medicina hiperbárica para tratar la intoxicación por monóxido de carbono o el síndrome de descompresión en buzos.
- Apoyo vital: Se usa en trajes espaciales, submarinos y para buceadores. En aviones, hay máscaras de oxígeno de emergencia que se activan si la cabina pierde presión.
- Oxicorte: Se usa para cortar metales gruesos con una llama muy caliente, mezclando oxígeno con acetileno.
Seguridad con el Oxígeno
Toxicidad del Oxígeno

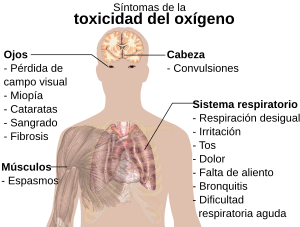
Aunque el oxígeno es vital, respirar oxígeno a presiones muy altas puede ser tóxico y causar problemas de salud, como convulsiones. Esto puede ocurrir en pacientes con ventilación mecánica o en buzos que descienden a grandes profundidades.
Por ejemplo, los buzos que respiran oxígeno puro a más de 6 metros de profundidad pueden sufrir toxicidad. En los trajes espaciales, se usa oxígeno casi puro, pero a una presión mucho más baja para evitar la toxicidad.
Riesgos de Incendio y Explosión

El oxígeno no es combustible, pero es un oxidante muy fuerte. Esto significa que ayuda a que las cosas se quemen muy rápido. Por eso, es peligroso tener oxígeno concentrado cerca de materiales inflamables.
Un ejemplo trágico fue el incendio del Apolo 1 en 1967. La cápsula estaba llena de oxígeno puro a una presión más alta de lo normal, y una chispa causó un incendio que se propagó muy rápido, costando la vida a la tripulación.
El oxígeno líquido también es peligroso. Si se derrama sobre materiales orgánicos como madera o asfalto, puede hacer que estos materiales exploten si reciben un impacto. Además, como es un líquido muy frío, puede causar congelamiento si entra en contacto con la piel.
Galería de imágenes
-
500 millones de años de cambio climático comparados con el nivel de 18O.
-
El agua (H2O) es el compuesto de oxígeno más familiar.
-
Los óxidos, como el óxido de hierro o el orín, se forman cuando el oxígeno se combina con otros elementos.
-
La acetona es un material importante para la industria química.
-
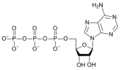
El oxígeno representa más del 40 % de la masa molecular de la molécula de la ATP.
-
La toxicidad del oxígeno tiene lugar cuando los pulmones toman una presión parcial del O2 mayor de lo normal, lo que puede suceder durante el buceo.
Véase también
 En inglés: Oxygen Facts for Kids
En inglés: Oxygen Facts for Kids