Masa atómica relativa para niños
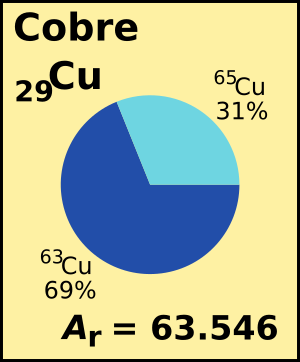
Nota: En este caso, se han utilizado valores procedentes de la CIAAW, redondeados para simplificar la presentación.
La masa atómica relativa (su símbolo es Ar) es un número que nos ayuda a comparar qué tan pesados son los átomos de un elemento. Antes se le llamaba peso atómico.
Para calcularla, se toma el promedio de las masas de los átomos de un elemento. Luego, se compara ese promedio con la doceava parte de la masa de un átomo de carbono-12. Esta doceava parte se conoce como unidad de masa atómica unificada.
La Comisión sobre Abundancia de Isótopos y Pesos Atómicos de la IUPAC publica regularmente los valores de la masa atómica relativa estándar. Estos valores son muy útiles en los laboratorios de química.
Contenido
¿Qué es la Masa Atómica Relativa?
¿Por qué la masa atómica relativa es un número decimal?
La mayoría de los elementos tienen diferentes tipos de átomos llamados isótopos. Los isótopos de un mismo elemento tienen el mismo número de protones, pero diferente número de neutrones. Esto significa que tienen masas atómicas diferentes.
Para calcular la masa atómica relativa de un elemento, se toma en cuenta la cantidad de cada isótopo que existe en la naturaleza. Por eso, la masa atómica relativa es un número decimal. Los números atómicos, en cambio, son siempre números enteros.
A veces, la masa atómica relativa se presenta como un rango de valores. Esto ocurre porque la proporción de los isótopos puede variar un poco según de dónde provenga el elemento.
¿Cómo se calcula la masa atómica relativa?
Para calcular la masa atómica relativa de un elemento, se siguen estos pasos:
- Para cada isótopo de un átomo:
Se divide la masa de un isótopo específico (por ejemplo, AX) entre la doceava parte de la masa de un átomo de carbono-12.
:
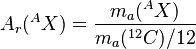
- Para un elemento químico completo:
Se suman las masas relativas de todos sus isótopos. Cada masa se multiplica por la abundancia (porcentaje) de ese isótopo en la naturaleza. Luego, se divide el resultado entre 100.
:
![A_r(Y) = \frac{ \sum [abundancia \cdot A_r(^{A}X)]} {100}](/images/math/1/c/8/1c8c6a27cead8a1a16b3f18b0a0f74f5.png)
Es importante recordar que la masa atómica relativa no es una cantidad fija. Puede variar ligeramente entre diferentes muestras de un elemento. Sin embargo, para la mayoría de los usos en química, es lo suficientemente constante. No hay que confundirla con la masa molecular, que es la masa de una molécula completa.
¿Cómo se define la masa atómica relativa?
La IUPAC define la masa atómica relativa así:
|
La masa atómica relativa de un elemento de una fuente específica es la relación de la masa promedio por átomo del elemento respecto a 1/12 de la masa de un átomo 12C.
|
La definición dice "una masa atómica" porque, dependiendo de dónde se obtenga un elemento, su masa atómica puede ser diferente. Por ejemplo, el boro de Turquía puede tener una masa atómica ligeramente distinta al boro de California. Esto se debe a que la mezcla de sus isótopos puede variar.
En 1960, se creó la unidad de masa atómica (símbolo: u). Se definió como 1/12 de la masa del carbono-12. Así, un átomo de carbono-12 tiene una masa de 12 u. Las tablas de masas atómicas relativas se basan en esta medida.
La masa molar de una molécula es la masa de un mol de esas moléculas. Un mol es una cantidad muy grande de átomos o moléculas. Se define como el número de átomos que hay en exactamente 12 gramos de carbono-12. A este número se le llama número de Avogadro, y su valor es aproximadamente 6,0221367 × 1023.
¿Cómo se miden las masas atómicas?
Las masas atómicas modernas se calculan usando mediciones muy precisas de la masa de cada tipo de átomo (nucleido) y su proporción en la naturaleza. Las masas de los átomos individuales se pueden medir con gran exactitud.
Sin embargo, la proporción de los isótopos en una muestra es más difícil de medir con mucha precisión. Esto se debe a que puede variar un poco entre diferentes muestras.
Por esta razón, las masas atómicas de los 22 elementos que tienen un solo tipo de átomo estable se conocen con una precisión muy alta. Por ejemplo, la del flúor es extremadamente precisa.
| Isótopo | Masa atómica | Abundancia (%) | |
|---|---|---|---|
| Estándar | Intervalo | ||
| 28Si | 27.976 926 532 46(194) | 92.2297(7) | 92.21-92.25 |
| 29Si | 28.976 494 700(22) | 4.6832(5) | 4.69-4.67 |
| 30Si | 29.973 770 171(32) | 3.0872(5) | 3.10-3.08 |
Un ejemplo es el silicio. En la naturaleza, el silicio es una mezcla de tres isótopos: 28Si, 29Si y 30Si.
Las masas de estos átomos se conocen con una precisión increíble. Sin embargo, la cantidad de cada isótopo en la naturaleza puede variar un poco.
El cálculo para el silicio es:
- Ar(Si) = (27.97693 × 0.922297) + (28.97649 × 0.046832) + (29.97377 × 0.030872) = 28.0854
La IUPAC indica que la masa atómica del silicio es 28,0855.
Lista de elementos y sus masas atómicas
Como se mencionó, la masa atómica de cada elemento se calcula según la proporción de sus isótopos estables que se encuentran en la naturaleza. Para cada isótopo, se suma el peso de sus protones y neutrones, y luego se calcula un promedio ponderado según su abundancia.
Los elementos con un solo isótopo estable, o con un isótopo mucho más común que los demás, tienen una masa atómica única. Los elementos que no tienen isótopos estables (porque son inestables y emiten energía) aparecen con el signo "(-)" en la tabla.
Desde 2010, la IUPAC decidió dar un rango de masas atómicas para algunos elementos. Esto refleja mejor cómo se encuentran estos elementos en la naturaleza. Por ejemplo, para el azufre, antes se usaba 32,065. Ahora, se indica que su valor puede estar entre [32,05 y 32,08], dependiendo de la muestra.
| Elemento | UMA | Elemento | UMA | Elemento | UMA | Elemento | UMA | Elemento | UMA | Elemento | UMA |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Actinio |
|
Cesio |
|
Fósforo |
|
Livermorio |
|
Platino |
|
Sodio |
|
| Aluminio |
|
Circonio |
|
Francio |
|
Lutecio |
|
Plomo |
|
Talio |
|
| Americio |
|
Cloro |
|
Gadolinio |
|
Magnesio |
|
Plutonio |
|
Tántalo |
|
| Antimonio |
|
Cobalto |
|
Galio |
|
Manganeso |
|
Polonio |
|
Tecnecio |
|
| Argón |
|
Cobre |
|
Germanio |
|
Meitnerio |
|
Potasio |
|
Telurio |
|
| Arsénico |
|
Copernicio |
|
Hafnio |
|
Mendelevio |
|
Praseodimio |
|
Terbio |
|
| Astato |
|
Cromo |
|
Hasio |
|
Mercurio |
|
Prometio |
|
Titanio |
|
| Azufre |
|
Curio |
|
Helio |
|
Molibdeno |
|
Protactinio |
|
Torio |
|
| Bario |
|
Darmstatio |
|
Hidrógeno |
|
Neodimio |
|
Radio |
|
Tulio |
|
| Berilio |
|
Disprosio |
|
Hierro |
|
Neón |
|
Radón |
|
Oganesón |
|
| Berkelio |
|
Dubnio |
|
Holmio |
|
Neptunio |
|
Renio |
|
Moscovio |
|
| Bismuto |
|
Einstenio |
|
Indio |
|
Niobio |
|
Rodio |
|
Teneso |
|
| Bohrio |
|
Erbio |
|
Yodo |
|
Níquel |
|
Roentgenio |
|
Nihonio |
|
| Boro |
|
Escandio |
|
Iridio |
|
Nitrógeno |
|
Rubidio |
|
Uranio |
|
| Bromo |
|
Estaño |
|
Iterbio |
|
Nobelio |
|
Rutenio |
|
Vanadio |
|
| Cadmio |
|
Estroncio |
|
Itrio |
|
Oro |
|
Rutherfordio |
|
Wolframio |
|
| Calcio |
|
Europio |
|
Kriptón |
|
Osmio |
|
Samario |
|
Xenón |
|
| Californio |
|
Fermio |
|
Lantano |
|
Oxígeno |
|
Seaborgio |
|
Zinc |
|
| Carbono |
|
Flerovio |
|
Lawrencio |
|
Paladio |
|
Selenio |
|
||
| Cerio |
|
Flúor |
|
Litio |
|
Plata |
|
Silicio |
|
Tabla periódica con masas atómicas
Aquí puedes ver la tabla periódica de la IUPAC (año 2016). Muestra todos los elementos químicos (del 1 al 118) y sus masas atómicas expresadas en Unidades de Masa Atómica.
| H [1,007-1,009] |
He 4,003 |
||||||||||||||||
| Li [6,938-6,997] |
Be 9,012 |
B [10,80-10,83] |
C [12,00-12,02] |
N [14,00-14,01] |
O [15,99-16,00] |
F 19 |
Ne 20,18 |
||||||||||
| Na 22,99 |
Mg [24,30-24,31] |
Al 26,98 |
Si [28,08-28,09] |
P 30,97 |
S [32,05-32,08] |
Cl [35,44-35,46] |
Ar 39,95 |
||||||||||
| K 39,1 |
Ca 40,08 |
Sc 44,96 |
Ti 47,87 |
V 50,94 |
Cr 52 |
Mn 54,94 |
Fe 55,85 |
Co 58,93 |
Ni 58,69 |
Cu 63,55 |
Zn 65,38 |
Ga 69,72 |
Ge 72,63 |
As 74,92 |
Se 78,97 |
Br [79,90-79,91] |
Kr 83,8 |
| Rb 85,47 |
Sr 87,62 |
Y 88,91 |
Zr 91,22 |
Nb 92,91 |
Mo 95,95 |
Tc | Ru 101,1 |
Rh 102,9 |
Pd 106,4 |
Ag 107,9 |
Cd 112,4 |
In 114,8 |
Sn 118,7 |
Sb 121,8 |
Te 127,6 |
I 126,9 |
Xe 131,3 |
| Cs 132,9 |
Ba 137,3 |
* |
Hf 178,5 |
Ta 180,9 |
W 183,8 |
Re 186,2 |
Os 190,2 |
Ir 192,2 |
Pt 195,1 |
Au 197 |
Hg 200,6 |
Tl [204,3-204,4] |
Pb 207,2 |
Bi 209 |
Po | At | Rn |
| Fr | Ra | ** |
Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| * |
La 138,9 |
Ce 140,1 |
Pr 140,9 |
Nd 144,2 |
Pm | Sm 150,4 |
Eu 152 |
Gd 157,3 |
Tb 158,9 |
Dy 162,5 |
Ho 164,9 |
Er 167,3 |
Tm 168,9 |
Yb 173 |
Lu 175 |
||
| ** |
Ac | Th 232 |
Pa 231 |
U 238 |
Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||
- Masas atómicas hasta el año 2010
Esta tabla fue reemplazada por la anterior. En ella, cada elemento tenía una única masa atómica en UMA. Todavía puede ser útil para cálculos que no necesiten mucha precisión o para revisar libros antiguos.
| H 1,0079 |
He 4,003 |
||||||||||||||||
| Li 6,941 |
Be 9,012 |
B 10,811 |
C 12,011 |
N 14,007 |
O 15,999 |
F 19 |
Ne 20,18 |
||||||||||
| Na 22,99 |
Mg 24,305 |
Al 26,98 |
Si 28,086 |
P 30,97 |
S 32,065 |
Cl 35,453 |
Ar 39,95 |
||||||||||
| K 39,1 |
Ca 40,08 |
Sc 44,96 |
Ti 47,87 |
V 50,94 |
Cr 52 |
Mn 54,94 |
Fe 55,85 |
Co 58,93 |
Ni 58,69 |
Cu 63,55 |
Zn 65,38 |
Ga 69,72 |
Ge 72,63 |
As 74,92 |
Se 78,97 |
Br 79,904 |
Kr 83,8 |
| Rb 85,47 |
Sr 87,62 |
Y 88,91 |
Zr 91,22 |
Nb 92,91 |
Mo 95,95 |
Tc | Ru 101,1 |
Rh 102,9 |
Pd 106,4 |
Ag 107,9 |
Cd 112,4 |
In 114,8 |
Sn 118,7 |
Sb 121,8 |
Te 127,6 |
I 126,9 |
Xe 131,3 |
| Cs 132,9 |
Ba 137,3 |
* |
Hf 178,5 |
Ta 180,9 |
W 183,8 |
Re 186,2 |
Os 190,2 |
Ir 192,2 |
Pt 195,1 |
Au 197 |
Hg 200,6 |
Tl 204,38 |
Pb 207,2 |
Bi 209 |
Po | At | Rn |
| Fr | Ra | ** |
Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| * |
La 138,9 |
Ce 140,1 |
Pr 140,9 |
Nd 144,2 |
Pm | Sm 150,4 |
Eu 152 |
Gd 157,3 |
Tb 158,9 |
Dy 162,5 |
Ho 164,9 |
Er 167,3 |
Tm 168,9 |
Yb 173 |
Lu 175 |
||
| ** |
Ac | Th 232 |
Pa 231 |
U 238 |
Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||
Más información
- Número atómico
- Unidad de masa atómica
- Masa atómica
- Isótopo
- Enlaces químicos
- Masa molecular
- Molécula
- Masa molar
- Anexo:Elementos químicos por orden alfabético
Véase también
 En inglés: Relative atomic mass Facts for Kids
En inglés: Relative atomic mass Facts for Kids

