Elemento químico para niños
Un elemento químico es un tipo de materia muy especial. Imagina que la materia es como un gran juego de construcción. Los elementos químicos serían las piezas más básicas e indivisibles de ese juego. Cada elemento está formado por átomos que son todos iguales entre sí.
Lo que hace que un átomo sea de un elemento u otro es la cantidad de protones que tiene en su núcleo. Este número se llama número atómico y es como el "carnet de identidad" de cada elemento. Por ejemplo, todos los átomos de oxígeno tienen 8 protones.
Un átomo es la parte más pequeña de un elemento que no se puede dividir en algo más simple usando una reacción química. A veces, átomos del mismo elemento pueden tener masas diferentes; a estos se les llama isótopos.
Es importante saber que un elemento químico es diferente de una "sustancia simple". Por ejemplo, el oxígeno (O) es un elemento. Pero el ozono (O3) y el dioxígeno (O2) son sustancias simples, hechas solo de átomos de oxígeno, pero con propiedades distintas porque sus átomos se unen de forma diferente.
Algunos elementos los encontramos en la naturaleza, formando parte de rocas, aire o agua. Otros han sido creados por científicos en laboratorios especiales, como los aceleradores de partículas o reactores atómicos. Estos elementos creados suelen ser muy inestables y duran muy poco tiempo. A lo largo de la historia del universo, las estrellas han sido como grandes fábricas que han creado muchos de los elementos que conocemos.
Los nombres de los elementos químicos se escriben con minúscula, a menos que una regla de ortografía indique lo contrario (por ejemplo, al inicio de una oración).
| Número atómico | Nombre | Símbolo | Periodo, Grupo |
Peso atómico (uma) |
Densidad (g/cm³) a 20°C |
Punto de fusión (°C) |
Punto de ebullición (°C) |
Año de su descubrimiento |
Persona que lo descubrió |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Hidrógeno | H | 1, 1 | 1.00784(7) | 0.084 g/l | -259.1 | -252.69 | 1766 | T. Von Hohenheim (Paracelso) |
| 2 | Helio | He | 1, 18 | 4.002602(2) | 0.17 g/l | -272.2 | -268.9 | 1895 | Ramsay y Cleve |
| 3 | Litio | Li | 2, 1 | 6.941(2) | 0.53 | 180.5 | 1317 | 1817 | Arfwedson |
| 4 | Berilio | Be | 2, 2 | 9.012182(3) | 1.85 | 1278 | 2970 | 1797 | Vauquelin |
| 5 | Boro | B | 2, 13 | 10.811(7) | 2.46 | 2300 | 2550 | 1808 | Davy y Gay-Lussac |
| 6 | Carbono | C | 2, 14 | 12.0107(8) | 3.51 | 3550 | 4827 | Prehistoria | Desconocido |
| 7 | Nitrógeno | N | 2, 15 | 14.0067(2) | 1.17 g/l | -209.9 | -195.8 | 1772 | Rutherford |
| 8 | Oxígeno | O | 2, 16 | 15.9994(3) | 1.33 g/l | -218.4 | -182.9 | 1774 | Priestly y Scheele |
| 9 | Flúor | F | 2, 17 | 18.9984032(5) | 1.58 g/l | -219.6 | -188.1 | 1886 | Moissan |
| 10 | Neón | Ne | 2, 18 | 20.1797(6) | 0.84 g/l | -248.7 | -246.1 | 1898 | Ramsay y Travers |
| 11 | Sodio | Na | 3, 1 | 22.98976928(2) | 0.97 | 97.8 | 892 | 1807 | Davy |
| 12 | Magnesio | Mg | 3, 2 | 24.3050(6) | 1.74 | 648.8 | 1107 | 1755 | Black |
| 13 | Aluminio | Al | 3, 13 | 26.9815386(8) | 2.70 | 660.5 | 2467 | 1825 | Oersted |
| 14 | Silicio | Si | 3, 14 | 28.0855(3) | 2.33 | 1410 | 2355 | 1824 | Berzelius |
| 15 | Fósforo | P | 3, 15 | 30.973762(2) | 1.82 | 44 (P4) | 280 (P4) | 1669 | Brand |
| 16 | Azufre | S | 3, 16 | 32.065(5) | 2.06 | 113 | 444.7 | Prehistoria | Desconocido |
| 17 | Cloro | Cl | 3, 17 | 35.453(2) | 2.95 g/l | -34.6 | -101 | 1774 | Scheele |
| 18 | Argón | Ar | 3, 18 | 39.948(1) | 1.66 g/l | -189.4 | -185.9 | 1894 | Ramsay y Rayleigh |
| 19 | Potasio | K | 4, 1 | 39.0983(1) | 0.86 | 63.7 | 774 | 1807 | Davy |
| 20 | Calcio | Ca | 4, 2 | 40.078(4) | 1.54 | 839 | 1487 | 1808 | Davy |
| 21 | Escandio | Sc | 4, 3 | 44.955912(6) | 2.99 | 1539 | 2832 | 1879 | Nilson |
| 22 | Titanio | Ti | 4, 4 | 47.867(1) | 4.51 | 1660 | 3260 | 1791 | Gregor y Klaproth |
| 23 | Vanadio | V | 4, 5 | 50.9415(1) | 6.09 | 1890 | 3380 | 1801 | del Río |
| 24 | Cromo | Cr | 4, 6 | 51.9961(6) | 7.14 | 1857 | 2482 | 1797 | Vauquelin |
| 25 | Manganeso | Mn | 4, 7 | 54.938045(5) | 7.44 | 1244 | 2097 | 1774 | Gahn |
| 26 | Hierro | Fe | 4, 8 | 55.845(2) | 7.87 | 1535 | 2750 | Prehistoria | Desconocido |
| 27 | Cobalto | Co | 4, 9 | 58.933200(9) | 8.89 | 1495 | 2870 | 1735 | Brandt |
| 28 | Níquel | Ni | 4, 10 | 58.6934(2) | 8.91 | 1453 | 2732 | 1751 | Cronstedt |
| 29 | Cobre | Cu | 4, 11 | 63.546(3) | 8.92 | 1083.5 | 2595 | Prehistoria | Desconocido |
| 30 | Zinc | Zn | 4, 12 | 65.409(4) | 7.14 | 419.6 | 907 | Prehistoria | Desconocido |
| 31 | Galio | Ga | 4, 13 | 69.723(1) | 5.91 | 29.8 | 2403 | 1875 | Lecoq de Boisbaudran |
| 32 | Germanio | Ge | 4, 14 | 72.64(1) | 5.32 | 937.4 | 2830 | 1886 | Winkler |
| 33 | Arsénico | As | 4, 15 | 74.92160(2) | 5.72 | 613 | 613 (sublimación) |
1250 | Albertus Magnus |
| 34 | Selenio | Se | 4, 16 | 78.96(3) | 4.82 | 217 | 685 | 1817 | Berzelius |
| 35 | Bromo | Br | 4, 17 | 79.904(1) | 3.14 | -7.3 | 58.8 | 1826 | Balard |
| 36 | Kriptón | Kr | 4, 18 | 83.798(2) | 3.48 g/l | -156.6 | -152.3 | 1898 | Ramsay y Travers |
| 37 | Rubidio | Rb | 5, 1 | 85.4678(3) | 1.53 | 39 | 688 | 1861 | Bunsen y Kirchhoff |
| 38 | Estroncio | Sr | 5, 2 | 87.62(1) | 2.63 | 769 | 1384 | 1790 | Crawford |
| 39 | Itrio | Y | 5, 3 | 88.90585(2) | 4.47 | 1523 | 3337 | 1794 | Gadolin |
| 40 | Zirconio | Zr | 5, 4 | 91.224(2) | 6.51 | 1852 | 4377 | 1789 | Klaproth |
| 41 | Niobio | Nb | 5, 5 | 92.906 38(2) | 8.58 | 2468 | 4927 | 1801 | Hatchett |
| 42 | Molibdeno | Mo | 5, 6 | 95.94(2) | 10.28 | 2617 | 5560 | 1778 | Scheele |
| 43 | Tecnecio | Tc | 5, 7 | [98.9063] | 11.49 | 2172 | 5030 | 1937 | Perrier y Segrè |
| 44 | Rutenio | Ru | 5, 8 | 101.07(2) | 12.45 | 2310 | 3900 | 1844 | Klaus |
| 45 | Rodio | Rh | 5, 9 | 102.90550(2) | 12.41 | 1966 | 3727 | 1803 | Wollaston |
| 46 | Paladio | Pd | 5, 10 | 106.42(1) | 12.02 | 1552 | 3140 | 1803 | Wollaston |
| 47 | Plata | Ag | 5, 11 | 107.8682(2) | 10.49 | 961.9 | 2212 | Prehistoria | Desconocido |
| 48 | Cadmio | Cd | 5, 12 | 112.411(8) | 8.64 | 321 | 765 | 1817 | Strohmeyer y Hermann |
| 49 | Indio | In | 5, 13 | 114.818(3) | 7.31 | 156.2 | 2080 | 1863 | Reich y Richter |
| 50 | Estaño | Sn | 5, 14 | 118.710(7) | 7.29 | 232 | 2270 | Prehistoria | Desconocido |
| 51 | Antimonio | Sb | 5, 15 | 121.760(1) | 6.69 | 630.7 | 1750 | Prehistoria | Desconocido |
| 52 | Teluro | Te | 5, 16 | 127.60(3) | 6.25 | 449.6 | 990 | 1782 | von Reichenstein |
| 53 | Yodo | I | 5, 17 | 126.90447(3) | 4.94 | 113.5 | 184.4 | 1811 | Courtois |
| 54 | Xenón | Xe | 5, 18 | 131.293(6) | 4.49 g/l | -111.9 | -107 | 1898 | Ramsay y Travers |
| 55 | Cesio | Cs | 6, 1 | 132.9054519(2) | 1.90 | 28.4 | 690 | 1860 | Kirchhoff y Bunsen |
| 56 | Bario | Ba | 6, 2 | 137.327(7) | 3.65 | 725 | 1640 | 1808 | Davy |
| 57 | Lantano | La | 6 | 138.90547(7) | 6.16 | 920 | 3454 | 1839 | Mosander |
| 58 | Cerio | Ce | 6 | 140.116(1) | 6.77 | 798 | 3257 | 1803 | W. Hisinger y Berzelius |
| 59 | Praseodimio | Pr | 6 | 140.90765(2) | 6.48 | 931 | 3212 | 1895 | von Welsbach |
| 60 | Neodimio | Nd | 6 | 144.242(3) | 7.00 | 1010 | 3127 | 1895 | von Welsbach |
| 61 | Prometio | Pm | 6 | [146.9151] | 7.22 | 1080 | 2730 | 1945 | Marinsky y Glendenin |
| 62 | Samario | Sm | 6 | 150.36(2) | 7.54 | 1072 | 1778 | 1879 | Lecoq de Boisbaudran |
| 63 | Europio | Eu | 6 | 151.964(1) | 5.25 | 822 | 1597 | 1901 | Demarçay |
| 64 | Gadolinio | Gd | 6 | 157.25(3) | 7.89 | 1311 | 3233 | 1880 | de Marignac |
| 65 | Terbio | Tb | 6 | 158.92535(2) | 8.25 | 1360 | 3041 | 1843 | Mosander |
| 66 | Disprosio | Dy | 6 | 162.500(1) | 8.56 | 1409 | 2335 | 1886 | Lecoq de Boisbaudran |
| 67 | Holmio | Ho | 6 | 164.93032(2) | 8.78 | 1470 | 2720 | 1878 | Soret |
| 68 | Erbio | Er | 6 | 167.259(3) | 9.05 | 1522 | 2510 | 1842 | Mosander |
| 69 | Tulio | Tm | 6 | 168.93421(2) | 9.32 | 1545 | 1727 | 1879 | Cleve |
| 70 | Iterbio | Yb | 6 | 173.04(3) | 6.97 | 824 | 1193 | 1878 | de Marignac |
| 71 | Lutecio | Lu | 6, 3 | 174.967(1) | 9.84 | 1656 | 3315 | 1907 | Urbain |
| 72 | Hafnio | Hf | 6, 4 | 178.49(2) | 13.31 | 2150 | 5400 | 1923 | Coster y de Hevesy |
| 73 | Tantalio | Ta | 6, 5 | 180.9479(1) | 16.68 | 2996 | 5425 | 1802 | Ekeberg |
| 74 | Wolframio | W | 6, 6 | 183.84(1) | 19.26 | 3407 | 5927 | 1783 | Elhuyar |
| 75 | Renio | Re | 6, 7 | 186.207(1) | 21.03 | 3180 | 5627 | 1925 | Noddack, Tacke y Berg |
| 76 | Osmio | Os | 6, 8 | 190.23(3) | 22.61 | 3045 | 5027 | 1803 | Tennant |
| 77 | Iridio | Ir | 6, 9 | 192.217(3) | 22.56 | 2410 | 4130 | 1803 | Tennant |
| 78 | Platino | Pt | 6, 10 | 195.084(9) | 21.45 | 1772 | 3827 | 1735 | de Ulloa |
| 79 | Oro | Au | 6, 11 | 196.966569(4) | 19.32 | 1064.4 | 2940 | Prehistoria | Desconocido |
| 80 | Mercurio | Hg | 6, 12 | 200.59(2) | 13.55 | -38.9 | 356.6 | Prehistoria | Desconocido |
| 81 | Talio | Tl | 6, 13 | 204.3833(2) | 11.85 | 303.6 | 1457 | 1861 | Crookes |
| 82 | Plomo | Pb | 6, 14 | 207.2(1) | 11.34 | 327.5 | 1740 | Prehistoria | Desconocido |
| 83 | Bismuto | Bi | 6, 15 | 208.98040(1) | 9.80 | 271.4 | 1560 | 1753 | Geoffroy |
| 84 | Polonio | Po | 6, 16 | [208.9824] | 9.20 | 254 | 962 | 1898 | Marie y Pierre Curie |
| 85 | Astato | At | 6, 17 | [209.9871] | 302 | 337 | 1940 | Corson y MacKenzie | |
| 86 | Radón | Rn | 6, 18 | [222.0176] | 9.23 g/l | -71 | -61.8 | 1900 | Dorn |
| 87 | Francio | Fr | 7, 1 | [223.0197] | 27 | 677 | 1939 | Perey | |
| 88 | Radio | Ra | 7, 2 | [226.0254] | 5.50 | 700 | 1140 | 1898 | Marie y Pierre Curie |
| 89 | Actinio | Ac | 7 | [227.0278] | 10.07 | 1047 | 3197 | 1899 | Debierne |
| 90 | Torio | Th | 7 | 232.03806(2) | 11.72 | 1750 | 4787 | 1829 | Berzelius |
| 91 | Protactinio | Pa | 7 | 231.03588(2) | 15.37 | 1554 | 4030 | 1917 | Hahn y Meitner |
| 92 | Uranio | U | 7 | 238.02891(3) | 18.97 | 1132.4 | 3818 | 1789 | Klaproth |
| 93 | Neptunio | Np | 7 | [237.0482] | 20.48 | 640 | 3902 | 1940 | McMillan y Abelson |
| 94 | Plutonio | Pu | 7 | [244.0642] | 19.81 | 641 | 3327 | 1940 | Seaborg |
| 95 | Americio | Am | 7 | [243.0614] | 13.67 | 1176 | 2607 | 1944 | Seaborg |
| 96 | Curio | Cm | 7 | [247.0703] | 13.51 | 1340 | 3110 | 1944 | Seaborg |
| 97 | Berkelio | Bk | 7 | [247.0703] | 14.79 | 1050 | 2627 | 1949 | Seaborg |
| 98 | Californio | Cf | 7 | [251.0796] | 15.1 | 900 | 1950 | Seaborg | |
| 99 | Einstenio | Es | 7 | [252.0829] | 860 | 1952 | Seaborg | ||
| 100 | Fermio | Fm | 7 | [257.0951] | 1952 | Seaborg | |||
| 101 | Mendelevio | Md | 7 | [258.0986] | 1955 | Seaborg | |||
| 102 | Nobelio | No | 7 | [259.1009] | 1958 | Seaborg | |||
| 103 | Laurencio | Lr | 7, 3 | [260.1053] | 1961 | Ghiorso | |||
| 104 | Rutherfordio | Rf | 7, 4 | [261.1087] | 1964/69 | Flerov | |||
| 105 | Dubnio | Db | 7, 5 | [262.1138] | 1967/70 | Flerov | |||
| 106 | Seaborgio | Sg | 7, 6 | [263.1182] | 1974 | Flerov | |||
| 107 | Bohrio | Bh | 7, 7 | [262.1229] | 1976 | Oganessian | |||
| 108 | Hassio | Hs | 7, 8 | [265] | 1984 | GSI (*) | |||
| 109 | Meitnerio | Mt | 7, 9 | [266] | 1982 | GSI | |||
| 110 | Darmstatio | Ds | 7, 10 | [269] | 1994 | GSI | |||
| 111 | Roentgenio | Rg | 7, 11 | [272] | 1994 | GSI | |||
| 112 | Copernicio | Cn | 7, 12 | [285] | 1996 | GSI | |||
| 113 | Nihonio | Nh | 7, 13 | [284] | 2004 | JINR (*), LLNL (*) | |||
| 114 | Flerovio | Fl | 7, 14 | [289] | 1999 | JINR | |||
| 115 | Moscovio | Mc | 7, 15 | [288] | 2004 | JINR, LLNL | |||
| 116 | Livermorio | Lv | 7, 16 | [290] | 2006 | JINR, LLNL(**) | |||
| 117 | Teneso | Ts | 7, 17 | 2009-2010 | JINR | ||||
| 118 | Oganesón | Og | 7, 18 | [294] | 2006 | JINR, LLNL(**) |
Contenido
Elementos en la Tabla Periódica
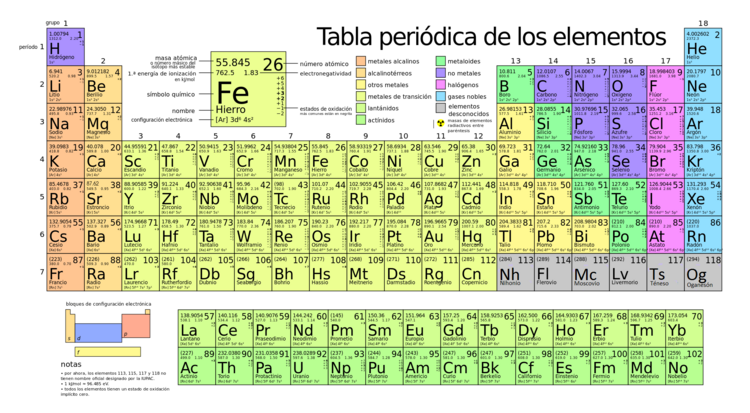
Los elementos químicos están organizados en la tabla periódica de los elementos. Esta tabla es como un mapa que nos ayuda a entender cómo se relacionan los elementos entre sí. Actualmente, conocemos más de 118 elementos.
El Elemento 118
Un equipo de científicos en Estados Unidos intentó descubrir el elemento 118 entre 2009 y 2010, pero no pudieron repetir el experimento. Sin embargo, científicos rusos sí lograron crearlo en 2006, y su descubrimiento ha sido aceptado por la comunidad científica.
¿De Dónde Vienen los Nombres de los Elementos?
Los nombres de los elementos químicos tienen orígenes muy variados. Muchos vienen del griego o del latín, otros del inglés, alemán o francés. Algunos llevan el nombre de su descubridor o del lugar donde fueron encontrados.
- Hidrógeno (H): Significa "engendrador de agua" en griego.
- Helio (He): Viene de "Helios", el dios griego del Sol, porque se descubrió primero en la atmósfera solar.
- Litio (Li): Del griego lithos, que significa "roca".
- Oxígeno (O): Significa "engendrador de ácidos" en griego.
- Sodio (Na): Su nombre viene del latín sodanum. El símbolo Na viene de nátrium.
- Magnesio (Mg): Nombrado por Magnesia, una región en Grecia.
- Aluminio (Al): Del latín alumen.
- Fósforo (P): Del griego phosphoros, que significa "portador de luz", porque brilla en la oscuridad.
- Cloro (Cl): Del griego chloros, que significa "amarillo verdoso".
- Argón (Ar): Del griego argos, que significa "inactivo", porque es un gas que no reacciona fácilmente.
- Hierro (Fe): Del latín ferrum.
- Plata (Ag): Del latín argentum.
- Oro (Au): Del latín aurum, que significa "aurora resplandeciente".
- Mercurio (Hg): Nombrado por el planeta. Su símbolo Hg viene del griego "plata acuática".
- Polonio (Po): En honor a Polonia, el país de origen de Marie Curie, quien lo descubrió.
- Uranio (U): Nombrado por el planeta Urano.
- Plutonio (Pu): Nombrado por el planetoide Plutón.
- Einstenio (Es): En honor a Albert Einstein.
- Mendelevio (Md): En honor a Dmitri Ivánovich Mendeléiev, quien creó la primera tabla periódica.
- Copernicio (Cn): En honor a Nicolás Copérnico, el astrónomo.
¿Cómo se Relacionan los Elementos con la Tabla Periódica?
La tabla periódica de los elementos es una herramienta clave en la química. Organiza los elementos químicos de forma lógica según su número atómico. Esto nos permite ver sus propiedades y cómo se comportan. Como ya sabes, algunos elementos se encuentran en la naturaleza, mientras que otros son creados por científicos en laboratorios.
Conceptos Clave
- Elementos: Son las sustancias más simples que no pueden dividirse en otras más pequeñas mediante reacciones químicas. Cada elemento tiene un tipo único de átomo.
- Tabla Periódica de los Elementos: Es una forma organizada de mostrar todos los elementos químicos conocidos, agrupándolos por sus características similares.
Descubrimiento de los Elementos
La historia del descubrimiento de los elementos es fascinante. Los científicos han ido encontrando y creando nuevos elementos a lo largo de los siglos.
Metales, No Metales y Metaloides
Una de las primeras formas de clasificar los elementos fue propuesta por Antoine Lavoisier. Él los dividió en metales, no metales y metaloides. Aunque esta clasificación es muy útil, no es perfecta porque hay muchas diferencias en las propiedades de cada grupo.
Metales
La mayoría de los metales tienen un brillo especial. Son buenos conductores del calor y la electricidad. También son maleables (se pueden convertir en láminas delgadas) y dúctiles (se pueden estirar para formar alambres). Casi todos los metales son sólidos a temperatura ambiente, excepto el mercurio, que es líquido.
Los metales suelen perder electrones en las reacciones químicas. Muchos se oxidan fácilmente al contacto con el aire o los ácidos.
Se usan mucho en la construcción, para hacer recipientes y para conducir el calor y la electricidad. Además, muchos metales son importantes para la vida, como el hierro, el calcio y el magnesio.
Algunos metales importantes son:
- Hierro (Fe): Muy abundante en la Tierra, es duro y magnético. Se usa para hacer acero.
- Magnesio (Mg): Esencial para la vida y se usa en aleaciones.
- Oro (Au): Un metal precioso, blando y brillante, muy valorado a lo largo de la historia.
- Plata (Ag): Otro metal precioso, es el mejor conductor de calor y electricidad.
- Aluminio (Al): Muy ligero y resistente a la corrosión, ideal para la industria.
- Níquel (Ni): Dúctil, maleable y buen conductor. Importante para enzimas y proteínas.
- Zinc (Zn): Se usa para proteger otros metales (galvanización).
- Plomo (Pb): Muy denso y bueno para bloquear la radiación.
- Estaño (Sn): Se usa en aleaciones para evitar la corrosión.
- Sodio (Na): Un metal muy reactivo, presente en la sal marina y vital para los seres vivos.
No Metales
Los no metales tienen una apariencia muy variada. No suelen ser brillantes y, en general, no conducen bien el calor ni la electricidad. Sus puntos de fusión son más bajos que los de los metales.
Muchos no metales son gases a temperatura ambiente (como el hidrógeno, nitrógeno y oxígeno), uno es líquido (bromo) y otros son sólidos (como el carbono o el azufre). A diferencia de los metales, son frágiles y no se pueden estirar.
Son muy importantes para los seres vivos, como el carbono, hidrógeno, oxígeno, nitrógeno, fósforo y azufre.
Comparación de Metales y No Metales
Metales
- Tienen brillo y suelen ser plateados.
- Son maleables (se hacen láminas) y dúctiles (se hacen hilos).
- Conducen bien el calor y la electricidad.
- Sus óxidos suelen ser sólidos y básicos.
- Tienden a perder electrones en reacciones químicas.
- Sus capas externas tienen pocos electrones (generalmente tres o menos).
No Metales
- No tienen brillo y tienen varios colores.
- Los sólidos son frágiles.
- Son malos conductores del calor y la electricidad.
- Sus óxidos suelen ser sustancias moleculares y ácidas.
- Tienden a ganar electrones en reacciones químicas.
- Sus capas externas tienen cuatro o más electrones (excepto hidrógeno y helio).
Localización en la Tabla Periódica
- Metales: Se encuentran a la izquierda y en el centro de la Tabla Periódica.
- No Metales: Se encuentran a la derecha de una línea imaginaria en la Tabla Periódica.
Elementos y Número Atómico
Un elemento químico es una sustancia pura formada por átomos que tienen el mismo número atómico, es decir, el mismo número de protones. Esto es lo que los hace únicos y les da sus propiedades. Por ejemplo, el oro tiene propiedades diferentes al hierro o al oxígeno.
Símbolo Químico
Los símbolos químicos son abreviaciones que usamos para identificar los elementos. Por ejemplo: C para carbono, O para oxígeno, H para hidrógeno, Fe para hierro, Ag para plata.
Estos símbolos fueron propuestos en 1814 por Jöns Jacob Berzelius. La primera letra del símbolo siempre es mayúscula, y la segunda (si la hay) es minúscula. Muchos símbolos vienen del latín, como Au para oro (de aurum) o Fe para hierro (de ferrum). Estos símbolos son universales, lo que significa que se usan igual en todo el mundo.
Los símbolos no solo nombran al elemento, sino que también nos dicen la cantidad relativa de átomos en una fórmula química. Un símbolo suele representar un átomo del elemento.
Véase también
 En inglés: Chemical element Facts for Kids
En inglés: Chemical element Facts for Kids
- Abundancia de los elementos químicos
- Nombres de los elementos
- Descubrimiento de los elementos químicos
- Elemento químico esencial
- Sólidos moleculares