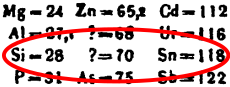Germanio para niños
Datos para niños Galio ← Germanio → Arsénico |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Germanio, Ge, 32 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Metaloides | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 14, 4, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 72,64 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Ar] 3d10 4s2 4p2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Mohs | 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 4 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Blanco grisáceo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 125 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 2,01 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 125 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 122 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de van der Waals | Sin datos pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | +4, 0, -1, -2, -3, -4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óxido | Anfótero | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 762 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 1537,5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª energía de ionización | 3302,1 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª energía de ionización | 4411 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5.ª energía de ionización | 9020 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 5323 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 1211,4 K (938 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 3093 K (2820 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 330,9 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 36,94 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 0,0000746 Pa a 1210 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto crítico | 245 K (−28 °C) 365 Pa |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volumen molar | 9876 m3/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Cúbica centrada en las caras | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 320 J/(kg·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | 1,45 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 59,9 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 5400 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del germanio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El germanio (símbolo Ge) es un elemento químico con el número atómico 32. Se encuentra en el período 4 de la tabla periódica de los elementos.
Es un semimetal de color blanco grisáceo, brillante, duro y fácil de romper. Se parece mucho al silicio y al estaño, que están cerca de él en la tabla periódica. El germanio puro es un semiconductor, lo que significa que puede conducir la electricidad bajo ciertas condiciones. En la naturaleza, el germanio se une con el oxígeno para formar otros compuestos.
El germanio no es muy común en grandes cantidades, por eso fue descubierto bastante tarde. En 1869, un científico llamado Dmitri Mendeléyev predijo que este elemento existía y algunas de sus características. Lo llamó ekasilicio. Casi veinte años después, en 1886, el científico alemán Clemens Winkler encontró el nuevo elemento en un mineral llamado argirodita. Winkler le dio el nombre de germanio en honor a su país, Alemania.
Hoy en día, el germanio se obtiene principalmente de un mineral de zinc llamado esfalerita. También se puede encontrar en minerales de plata, plomo y cobre.
El germanio se usa mucho en la tecnología moderna. Es un material clave para:
- Fibra óptica: cables que transmiten información usando luz.
- Óptica infrarroja: para cámaras de visión nocturna y otros equipos que ven el calor.
- Células solares y luces LED.
- Transistores y otros componentes electrónicos.
También se usa en algunos catalizadores para fabricar plásticos.
Contenido
¿Qué es el Germanio?
El germanio es un semimetal que tiene un color blanco grisáceo y es brillante. Es un material duro y quebradizo. Mantiene su brillo a temperaturas normales. Su estructura es similar a la del diamante y no se daña fácilmente con ácidos o álcalis.
¿Por qué es importante como semiconductor?
El germanio es un semiconductor muy útil. Esto significa que puede controlar el flujo de electricidad. A diferencia de otros semiconductores, el germanio tiene una "banda prohibida" pequeña. Esto le permite responder bien a la radiación infrarroja, lo que lo hace ideal para amplificadores de baja potencia y detectores de luz infrarroja.
Usos del Germanio en la Vida Diaria
El germanio es un elemento valioso, aunque su alto costo limita algunos de sus usos. Sin embargo, es esencial en muchas tecnologías.
- Cables de fibra óptica: Se usa para transmitir datos a alta velocidad en internet y telecomunicaciones.
- Electrónica: Fue fundamental en los primeros transistores. Hoy se usa en circuitos integrados de alta velocidad y en algunos amplificadores de guitarras eléctricas para lograr sonidos clásicos.
- Óptica infrarroja: Como metal, el germanio es transparente a la luz infrarroja. Se utiliza en espectroscopios, sistemas de visión nocturna y otros equipos especiales.
- Lentes: Se usa para fabricar lentes con un alto índice de refracción, ideales para cámaras de gran angular y microscopios.
- Joyería: Se mezcla con oro (una aleación de oro con 12% de germanio) para crear piezas especiales.
- Aleaciones: Ayuda a endurecer metales como el aluminio, magnesio y estaño.
- Medicina: Algunos compuestos de germanio se investigan por sus posibles usos en tratamientos médicos.
- Catalizadores: El tetracloruro de germanio se usa como catalizador para fabricar plásticos como el PET. Este es uno de sus usos principales hoy en día.
Descubrimiento del Germanio
Las características del germanio fueron predichas en 1871 por Dmitri Mendeléyev. Él lo llamó eka-silicio basándose en su lugar en la tabla periódica. En 1886, el científico alemán Clemens Winkler confirmó la existencia de este elemento. Su descubrimiento fue muy importante porque demostró que la tabla periódica de Mendeléyev era correcta.
Aquí puedes ver cómo las predicciones de Mendeléyev se compararon con lo que Winkler encontró:
| Propiedad | Ekasilicio | Germanio |
|---|---|---|
| (Predichas, 1871) | (Observadas, 1886) | |
| Masa atómica | 72 | 72,59 |
| Densidad (g/cm³) | 5,5 | 5,35 |
| Calor específico (kJ/kg·C) | 0,31 | 0,32 |
| Punto de fusión (°C) | alto | 960 |
| Fórmula del óxido | RO2 | GeO2 |
| Fórmula del cloruro | RCl4 | GeCl4 |
| Densidad del óxido (g/cm³) | 4,7 | 4,7 |
| Punto de ebullición del cloruro (°C) | 100 | 86 |
| Color | gris | gris |
En 1885, se encontró un nuevo mineral rico en plata llamado argyrodita en una mina en Alemania. Clemens Winkler analizó este mineral y descubrió que contenía un nuevo elemento. Al principio, pensó en llamarlo "neptunio", pero ese nombre ya se había usado para otro elemento propuesto. Así que Winkler decidió llamarlo germanio, en honor a su país natal, Alemania.
¿De dónde se obtiene el Germanio?
El germanio se encuentra en yacimientos de plata, zinc y cobre. Los minerales más importantes para obtener germanio son la germanita (con un 69% de germanio) y la garnierita (con un 7-8% de germanio). También se encuentra en el carbón y en otros minerales.
La mayor parte del germanio se obtiene como un subproducto de la producción de zinc o de la quema de carbón. Para purificarlo, se convierte en un compuesto llamado tetracloruro de germanio, que luego se transforma en germanio puro usando hidrógeno o magnesio.
Para usos electrónicos, el germanio se purifica aún más hasta alcanzar una pureza del 99.99%. Esto se hace con una técnica especial que reduce las impurezas a niveles muy bajos.
En 1926, se descubrió que el germanio era un semiconductor. Sin embargo, no fue hasta 1942 que se pudo producir de forma económica. El desarrollo de los transistores de germanio a partir de 1947 fue un gran avance para la electrónica. Entre 1950 y principios de los años 70, el germanio fue muy demandado en la electrónica. Luego, el silicio lo reemplazó en muchos usos porque era más barato. Hoy en día, el germanio se usa principalmente en fibra óptica, equipos de visión nocturna y como catalizador para plásticos.
Isótopos del Germanio
El germanio tiene cinco isótopos que son estables, es decir, que no cambian con el tiempo. El más común es el Ge-74. También se conocen 18 isótopos radiactivos, que se desintegran con el tiempo. El Ge-68 es el que dura más, con una vida media de 270.8 días.
Seguridad y el Germanio
Algunos compuestos de germanio, como el tetrahidruro de germanio, pueden ser perjudiciales para los mamíferos si se ingieren en grandes cantidades. Sin embargo, son útiles para eliminar ciertas bacterias y parásitos como la taenia.
El germanio que se encuentra en la naturaleza, a menudo como impureza en otros minerales, no suele ser muy dañino porque no se disuelve fácilmente en agua. El cuerpo lo elimina rápidamente, principalmente a través de la orina. Sin embargo, algunos compuestos de germanio hechos por el hombre pueden ser más perjudiciales si se consumen en exceso.
Galería de imágenes
Véase también
 En inglés: Germanium Facts for Kids
En inglés: Germanium Facts for Kids