Metano para niños
Datos para niños
Metano |
||
|---|---|---|
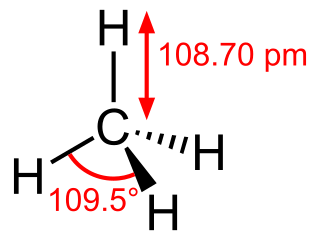 Estructura química.
|
||
 Estructura tridimensional.
|
||
| Nombre IUPAC | ||
| Metano | ||
| General | ||
| Otros nombres | Tetrahidruro de carbono Hidruro de metilo Gas del pantano |
|
| Fórmula molecular | CH₄ | |
| Identificadores | ||
| Número CAS | 74-82-8 | |
| Número RTECS | PA1490000 | |
| ChEBI | 16183 | |
| ChEMBL | CHEMBL17564 | |
| ChemSpider | 291 | |
| PubChem | 297 | |
| KEGG | C01438 | |
|
C
|
||
|
InChI
InChI=1S/CH4/h1H4
Key: VNWKTOKETHGBQD-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Gas incoloro | |
| Olor | Inodoro | |
| Densidad | 0,657 kg/m³; 0,000657 g/cm³ | |
| Masa molar | 16,04206 g/mol | |
| Punto de fusión | 90,7 K (−182 °C) | |
| Punto de ebullición | 111,65 K (−162 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 22.7 mg/L−1 (insoluble) | |
| Solubilidad | Soluble en etanol, éter dietílico, benceno, tolueno, metanol, acetona. | |
| Momento dipolar | 0 D | |
| log P | 1.09 | |
| Termoquímica | ||
| Capacidad calorífica (C) | 35.69 J·(K·mol)−1 | |
| Peligrosidad | ||
| SGA |   |
|
| Punto de inflamabilidad | 85,1 K (−188 °C) | |
| NFPA 704 |
4
2
0
|
|
| Temperatura de autoignición | 810 K (537 °C) | |
| Frases H | H220 H280 | |
| Frases P | P210 P337 P381 P403 P410+403 | |
| Límites de explosividad | 4.4–17% | |
| Riesgos | ||
| Inhalación | Asfixia; en algunos casos inconsciencia, ataque cardíaco o lesiones cerebrales. | |
| Piel | El compuesto se transporta como líquido criogénico. Su exposición causará la congelación. | |
| LD50 | 5-15.4 % | |
| Más información | NIST WebBook | |
| Compuestos relacionados | ||
| Alcanos relacionados |
|
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El metano es el hidrocarburo más simple, con la fórmula química CH
4. Imagina que es como el "bloque de construcción" más pequeño de una gran familia de compuestos llamados alcanos.
Cada átomo de hidrógeno en el metano está unido al carbono central. Es un gas que no tiene color ni olor. Además, no se mezcla con el agua.
En la naturaleza, el metano se forma cuando las plantas se descomponen sin oxígeno. Este proceso se llama descomposición anaeróbica. Podemos usar este proceso natural para crear biogás, una fuente de energía. Muchos microorganismos que viven sin oxígeno producen metano.
El gas natural que usamos en casa contiene mucho metano, entre el 83% y el 97%. El gas natural que se vende es principalmente metano, con pequeñas cantidades de otros gases. En las minas de carbón, el metano se conoce como grisú. Es muy peligroso porque puede encenderse y explotar fácilmente. Sin embargo, hoy en día, el metano de las minas de carbón también se usa como fuente de energía.
El metano es un gas de efecto invernadero que contribuye al calentamiento global de la Tierra. Esto significa que ayuda a atrapar el calor en nuestra atmósfera. Un kilogramo de metano calienta la Tierra 23 veces más que la misma cantidad de dióxido de carbono en 100 años. Aunque hay mucho más dióxido de carbono en el aire, reducir las emisiones de metano es importante. Esto puede ayudar a limitar el calentamiento a corto plazo y mejorar la calidad del aire.
Contenido
¿Es seguro el metano?
El metano no es venenoso por sí mismo. Sin embargo, su principal peligro es que es muy fácil de encender. Puede formar mezclas explosivas con el aire. Por eso, es importante tener cuidado con él. El metano también reacciona con otras sustancias químicas.
Si hay mucho metano en un lugar cerrado y sin ventilación, puede desplazar el oxígeno. Esto significa que el metano ocupa el lugar del oxígeno, lo que puede causar asfixia. Sin embargo, las concentraciones que pueden explotar son mucho menores que las que causarían asfixia.
En lugares como los vertederos, donde se descompone mucha basura, se puede liberar metano. Si hay edificios cerca, el metano podría entrar. Algunos edificios tienen sistemas especiales para capturar este gas y sacarlo. Un ejemplo es el edificio Dakin en Brisbane (California).
¿Cómo reacciona el metano?
Las reacciones más importantes del metano son la combustión (cuando se quema), la reformación con vapor para producir gas de síntesis, y la halogenación (cuando reacciona con halógenos). Controlar estas reacciones puede ser complicado. Por ejemplo, es difícil convertir metano en metanol sin que se convierta en dióxido de carbono y agua.
Combustión del metano
Cuando el metano se quema, ocurren varios pasos:
- Primero, el metano reacciona con el oxígeno.
- Luego, se descompone en otras sustancias.
- Finalmente, el hidrógeno y el monóxido de carbono que se forman se queman, liberando calor y produciendo agua y dióxido de carbono.
- CH
4 + 2O
2 → CO
2 + 2H
2O
Reformación del metano
El enlace entre el carbono y el hidrógeno en el metano es muy fuerte. Esto hace que sea difícil usarlo como materia prima para otras cosas. Sin embargo, el metano es la principal sustancia para producir hidrógeno a través de un proceso llamado reformación con vapor. Los científicos investigan cómo hacer que este proceso sea más fácil.
Halogenación del metano
El metano puede reaccionar con elementos llamados halógenos, como el flúor o el cloro, bajo ciertas condiciones.
- CH
4 + X
2 → CH
3X + HX
Aquí, X representa un halógeno.
¿Para qué se usa el metano?
Como combustible
El metano es muy importante para generar electricidad. Se usa como combustible en turbinas de gas y en generadores de vapor.
Aunque el metano produce menos calor por mol que otros hidrocarburos, si lo comparamos por su masa, el metano produce más calor. En muchas ciudades, el metano se transporta por tuberías a las casas para la calefacción y para cocinar. A esto lo llamamos gas natural. En algunos países, el gas natural también se usa como combustible para vehículos.
Usos industriales
El metano se usa en la industria química. Se puede transportar como un líquido muy frío, llamado gas natural licuado (GNL). Cuando el GNL se escapa, al principio es más pesado que el aire, pero a temperatura ambiente se vuelve más ligero. Los gasoductos son tuberías gigantes que transportan grandes cantidades de gas natural, cuyo componente principal es el metano.
En la industria química, el metano es la base para producir hidrógeno, metanol, ácido acético y anhídrido acético. Para esto, el metano se convierte primero en gas de síntesis, una mezcla de monóxido de carbono e hidrógeno. Esto se hace con vapor de agua y un catalizador de níquel a altas temperaturas.
- CH
4 + H
2O → CO + 3H
2
También se pueden obtener otros productos químicos del metano, como el acetileno y los clorometanos. Sin embargo, el uso de estos últimos está disminuyendo por razones de salud y ambientales.
¿De dónde viene el metano?
Fuentes naturales
Alrededor del 60% del metano que se emite en el mundo proviene de actividades humanas.
La mayor parte del metano se obtiene de depósitos geológicos, conocidos como campos de gas natural. Se encuentra junto a otros hidrocarburos y a veces con helio y nitrógeno. El gas en depósitos poco profundos se forma por la descomposición de materia orgánica. El resto se cree que viene de las profundidades de la Tierra.
También se puede extraer metano de los depósitos de carbón. Se perforan pozos en las capas de carbón y se bombea agua para liberar el metano. Esta técnica produce el 7% del gas natural en Estados Unidos. Sin embargo, puede afectar el nivel del acuífero y el agua extraída puede contener contaminantes.
Los hidratos de metano, o clatratos, son combinaciones de hielo y metano que se encuentran en el fondo del océano. Son una posible fuente futura de metano, pero aún no se explotan comercialmente.
El metano también se produce por:
- La metanogénesis, un proceso de organismos que viven sin oxígeno.
- La digestión y defecación de animales, especialmente el ganado (17%).
- Las bacterias en las plantaciones de arroz (12%).
- La digestión anaeróbica de la biomasa.
Fuentes alternativas
Además de los campos de gas natural, podemos obtener metano del biogás. Este se genera por la fermentación de materia orgánica de estiércoles, lodos de aguas residuales, basura doméstica o cualquier otra materia biodegradable, en ausencia de oxígeno.
El metano también se puede producir industrialmente a partir de hidrógeno y dióxido de carbono mediante el proceso Sabatier.
- CO
2 + 4H
2 → CH
4 + 2H
2O.
El metano en la atmósfera de la Tierra
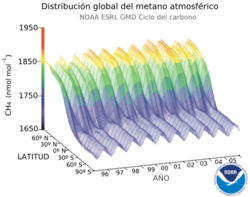
El metano es un gas de efecto invernadero muy importante en la atmósfera de la Tierra. Su potencial de calentamiento es 23 veces mayor que el del dióxido de carbono en un período de 100 años. Esto significa que un kilogramo de metano tiene un impacto 23 veces mayor que un kilogramo de dióxido de carbono en ese tiempo. El metano tiene un efecto fuerte pero de corta duración (unos 10 años), mientras que el dióxido de carbono tiene un efecto menor pero más duradero (unos 100 años).
La cantidad de metano en la atmósfera ha aumentado en los últimos cinco mil años. Se cree que esto se debe a la agricultura, especialmente al riego de arroz.
Hace unos siete mil años, en Oriente Próximo, se descubrió el regadío. Esta práctica se extendió, creando humedales artificiales. En estos humedales, la vegetación crecía, moría y se descomponía, liberando metano.
La concentración de metano ha aumentado un 150% desde 1750 hasta 1998. Es responsable del 20% del efecto de calentamiento de todos los gases de efecto invernadero de larga duración.
En 1998, la concentración media de metano en la superficie de la Tierra era de 1,745 ppb. En 2018, era de 1857,5 ppb. En 2019, un estudio sugirió que el aumento de la producción de gas de esquisto en América del Norte ha contribuido a este incremento.
La concentración de metano es más alta en el hemisferio norte porque la mayoría de las fuentes (naturales y humanas) están allí. Las concentraciones cambian con las estaciones del año, siendo más bajas a finales del verano.
El metano se forma cerca de la superficie y sube a la estratosfera. La cantidad de metano en la atmósfera se controla naturalmente por su reacción con el radical hidroxilo. Esta molécula se forma cuando el oxígeno reacciona con el agua.
Al principio de la historia de la Tierra, hace unos 3500 millones de años, había mil veces más metano en la atmósfera que ahora. Este metano inicial fue liberado por la actividad volcánica. Fue en esta época cuando apareció la vida en la Tierra. Las primeras formas de vida incluían bacterias que producían metano a partir de hidrógeno y dióxido de carbono.
El oxígeno no era un componente principal de la atmósfera hasta que aparecieron los organismos que hacían fotosíntesis. Sin oxígeno, el metano podía permanecer en la atmósfera por más tiempo y en mayores cantidades que hoy.
El cambio climático podría aumentar los niveles de metano en la atmósfera al liberar más metano de los ecosistemas naturales.
Emisiones de metano
Aquí puedes ver de dónde viene el metano y cómo se elimina de la atmósfera:
| Origen | Emisiones de CH4 | ||
|---|---|---|---|
| Masa (Tg/año) | Porcentaje (%/año) | Total (%/año) | |
| Emisiones naturales | |||
| Humedales (incl. arrozales) | 225 | 83 | 37 |
| Termitas | 20 | 7 | 3 |
| Océano | 15 | 6 | 3 |
| Hidratos | 10 | 4 | 2 |
| Total Natural | 270 | 100 | 45 |
| Emisiones humanas | |||
| Energía | 110 | 33 | 18 |
| Basureros | 40 | 12 | 7 |
| Ganadería de Rumiantes (bovinos) |
115 | 35 | 19 |
| Tratamiento de desechos | 25 | 8 | 4 |
| Combustión de Biomasa | 40 | 12 | 7 |
| Total Humano | 330 | 100 | 55 |
| Sumideros (lugares donde se elimina) | |||
| Suelos | 30 | 5 | 5 |
| OH Troposférico | 510 | 88 | 85 |
| Pérdida estratosférica | 40 | 7 | 7 |
| Total sumideros | 580 | 100 | 97 |
| Emisiones - Sumideros | |||
| Desequilibrio (tendencia) | +20 | ~2,78 Tg/ppmm | +7,19 ppmm/a |
Casi la mitad de las emisiones totales de metano provienen de la actividad humana. Recientemente, se ha descubierto que las plantas (como los bosques) también emiten metano. Las mediciones a largo plazo muestran que el aumento de metano en la atmósfera ha disminuido. Se cree que esto se debe a menos emisiones industriales y a la sequía en las zonas húmedas.
Liberación de metano de los clatratos
A altas presiones, como en el fondo del océano, el metano forma una sustancia sólida con el agua llamada hidrato de metano. No se sabe cuánto metano hay atrapado así en los sedimentos del océano, pero podría ser una cantidad enorme.
Existe una teoría llamada "hipótesis del fusil de clatratos". Sugiere que si el calentamiento global aumenta la temperatura de estos depósitos, todo este metano podría liberarse de repente a la atmósfera. Como el metano es un gas de efecto invernadero muy potente, esto aumentaría mucho el calentamiento de la Tierra. Esta teoría podría explicar calentamientos rápidos en el pasado de la Tierra.
Emisión de metano de las turberas
Aunque no es tan drástico como lo de los clatratos, ya está ocurriendo un aumento en las emisiones de metano de las turberas. Esto sucede a medida que el permafrost (suelo permanentemente congelado) se derrite. En los últimos años, se han registrado récords de deshielo en el permafrost de Alaska y Siberia.
Las mediciones recientes en Siberia muestran que el metano liberado es cinco veces mayor de lo que se pensaba.
¿Cómo se elimina el metano?
El metano se elimina de la atmósfera principalmente al reaccionar con el radical hidroxilo. Esta molécula se forma cuando los rayos cósmicos chocan con las moléculas de vapor de agua.
- CH
4 + ·OH → ·CH
3 + H
2O
Esta reacción hace que el metano dure unos 9,6 años en la troposfera. Otros lugares donde se elimina el metano son el suelo y la estratosfera, lo que da una vida total de unos 8,4 años.
El metano en Marte
La presencia de metano en Marte es un misterio y podría ser una señal de vida en el planeta. La cantidad de este gas en la atmósfera marciana cambia con las estaciones, lo que sugiere que hay una fuente activa, ya sea geológica o biológica.
Syrtis Major es una de las regiones de Marte donde se cree que se origina el metano.
El metano en Marte se descubrió en 2003. Aparece en la atmósfera marciana en una proporción de 10 partes por cada mil millones. La atmósfera de Marte está compuesta en un 95% por dióxido de carbono.
La sonda europea Mars Express confirmó que el metano está presente de forma permanente. Como el metano se degrada con la luz, su presencia continua solo se explica si hay una fuente que lo renueva.
El origen del metano marciano podría ser geológico (como volcanes, aunque no hay evidencia de volcanes activos en la superficie) o biológico. Si fuera biológico, podrían ser microbios que viven sin oxígeno, quizás bajo la superficie en posible agua líquida.
Según la revista Science en enero de 2009, se usaron telescopios terrestres para observar el metano durante tres años marcianos (equivalentes a 7 años terrestres). Se vio que el metano varía con el tiempo y se acumula en ciertas regiones.
Se observó que la fuente principal liberaba unas 19.000 toneladas de metano, con una emisión de 600 gramos por segundo.
La vida del metano en Marte es muy corta, de unos cuatro años terrestres. Quizás se degrada por sustancias oxidantes presentes en el polvo.
Una teoría sugiere que hay microbios bajo el hielo marciano. Allí, la radiación podría producir hidrógeno a partir de agua líquida, y el CO2 proporcionaría el carbono para producir metano.
El rover marciano MSL, conocido como "Curiosity", tiene sistemas para medir metano y determinar qué tipo de carbono contiene. Si fuera carbono-12, podría indicar un origen biológico.
Fuentes principales de metano
Las principales fuentes de metano son:
- Descomposición de residuos orgánicos por bacterias.
- Fuentes naturales como los pantanos (23%).
- Extracción de combustibles fósiles (20%). Antes, el metano se quemaba o se liberaba directamente. Hoy en día, se intenta almacenar para usarlo como gas natural.
- Los procesos de digestión y defecación de animales (17%), especialmente del ganado.
- Las bacterias en las plantaciones de arroz (12%).
- Digestión anaeróbica de la biomasa.
- Materia viva vegetal (se ha descubierto que plantas y árboles emiten metano).
El 60% de las emisiones globales provienen de actividades humanas, principalmente de la agricultura. La concentración de metano en la atmósfera ha aumentado de 0,8 a 1,7 ppm. Se teme que aumente mucho más si el metano almacenado en el fondo del Ártico se libera debido al aumento de la temperatura de los océanos.
Propiedades del metano
Véase también
 En inglés: Methane Facts for Kids
En inglés: Methane Facts for Kids
- Alcano
- Calentamiento global
- Clatrato de metano
- Hidrocarburos
- Organismo metanógeno
- serpentinización
- Gasura


