Protactinio para niños
Datos para niños Torio ← Protactinio → Uranio |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
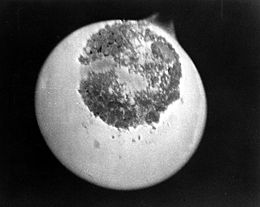 Muestra de Protactinio-233 (área circular oscura de la imagen) fotografiada a la luz de su propia emisión radioactiva.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Protactinio, Pa, 91 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Actínidos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | -, 7, f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 231.03588 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Rn] 5f2 6d1 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 32, 20, 9, 2 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Blanco plateado brillante | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 180 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,5 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 163 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 200 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 2, 3, 4, 5 (base débil) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 568 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 15370 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 2113 K (1840 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 4300 K (4027 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 470 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 15 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 5,1 × 10-5 Pa a 2200 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Tetragonal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 120 J/(kg·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | 5,29 × 106 m-1 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 47 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del protactinio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El protactinio es un elemento químico muy especial que se encuentra en la tabla periódica. Su símbolo es Pa y su número atómico es 91. Es un metal plateado que brilla mucho.
El protactinio es un elemento radiactivo, lo que significa que sus átomos no son estables y se transforman con el tiempo, liberando energía. Es muy raro en la naturaleza y, por eso, se usa principalmente en la investigación científica.
Contenido
Protactinio: Un Elemento Fascinante
El protactinio es un metal de color blanco plateado y brillante. Pertenece a un grupo de elementos llamados actínidos. Una de sus propiedades más interesantes es que se vuelve superconductor a temperaturas muy bajas, por debajo de 1.4 K (que es casi -271.75 grados Celsius).
¿Quién Descubrió el Protactinio?
La historia del descubrimiento del protactinio es bastante larga y tiene varios protagonistas:
- En 1871, el científico ruso Dimitri Ivánovic Mendeléiev predijo que debía existir un elemento con el número 91, ubicado entre el torio y el uranio en su tabla periódica.
- En 1900, William Crookes aisló un material radiactivo del uranio, pero no pudo identificarlo como un nuevo elemento.
- El protactinio fue identificado por primera vez en 1913 por Kasimir Fajans y O.H. Göhring. Ellos encontraron un tipo de protactinio de vida muy corta, llamado protactinio-234, y lo nombraron Brevium (que significa "breve" en latín).
- Más tarde, entre 1917 y 1918, dos equipos de científicos descubrieron de forma independiente un tipo de protactinio más estable, el protactinio-231. Estos equipos fueron Otto Hahn y Lise Meitner en Alemania, y Frederick Soddy y John Cranston en el Reino Unido.
- En 1949, la IUPAC (la organización que nombra los elementos químicos) decidió que el nombre oficial sería "protactinio". Este nombre significa "precursor del actinio", porque el actinio se forma cuando el protactinio se descompone.
¿Cómo se Encuentra el Protactinio?
El protactinio se encuentra de forma natural en los minerales de uranio y torio. Esto se debe a que el protactinio se forma cuando estos elementos se descomponen. Por ejemplo, en un mineral llamado uraninita (también conocida como pechblenda), hay aproximadamente una parte de protactinio-231 por cada 10 millones de partes de mineral. Algunas minas en la República Democrática del Congo pueden tener concentraciones un poco más altas.
En 1934, Aristid V. Grosse logró aislar por primera vez una pequeña cantidad de protactinio puro. Años después, en 1961, una autoridad de energía atómica en el Reino Unido produjo 125 gramos de protactinio puro, lo que fue un gran logro en ese momento.
¿Para qué se Usa el Protactinio?
Debido a que es muy raro, muy radiactivo y puede ser perjudicial, el protactinio no tiene muchos usos prácticos fuera de los laboratorios de investigación.
Sin embargo, el protactinio-231, que se forma a partir del uranio-235, ha sido estudiado por su potencial en reacciones nucleares. También se utiliza en la ciencia para entender mejor los océanos antiguos. Los científicos analizan las cantidades de diferentes tipos de uranio, torio y protactinio en el agua y los minerales para saber la edad de los sedimentos (hasta 175,000 años) y para estudiar cómo han cambiado los procesos geológicos de la Tierra.
Sus Diferentes Tipos (Isótopos)
Los isótopos son versiones de un mismo elemento que tienen el mismo número de protones, pero diferente número de neutrones. Se han descubierto 29 tipos diferentes de protactinio.
Los isótopos más estables son:
- Protactinio-231 (231Pa): Es el más común en la naturaleza y tiene una vida media de 32,760 años. Esto significa que tarda 32,760 años en que la mitad de una muestra de este isótopo se descomponga.
- Protactinio-233 (233Pa): Tiene una vida media de casi 30 días.
- Protactinio-230 (230Pa): Tiene una vida media de 17.4 días.
La mayoría de los otros isótopos de protactinio son mucho menos estables y se desintegran muy rápidamente.
¡Cuidado con el Protactinio!
El protactinio es un elemento que debe manejarse con mucho cuidado. Es radiactivo y puede ser perjudicial para la salud. Por eso, solo los científicos especializados y con el equipo de seguridad adecuado pueden trabajar con él.
Galería de imágenes
Véase también
 En inglés: Protactinium Facts for Kids
En inglés: Protactinium Facts for Kids


