Dióxido de carbono para niños
Datos para niños
Dióxido de carbono |
||
|---|---|---|
 |
||
 |
||
| General | ||
| Otros nombres | Óxido de carbono(IV) Anhídrido carbónico Gas carbónico |
|
| Fórmula semidesarrollada | CO2 | |
| Fórmula estructural | ||
| Fórmula molecular | CO2 | |
| Identificadores | ||
| Número CAS | 124-38-9 | |
| Número RTECS | FF6400000 | |
| ChEBI | 16526 | |
| ChEMBL | CHEMBL1231871 | |
| ChemSpider | 274 | |
| DrugBank | DB09157 | |
| PubChem | 280 | |
| UNII | 142M471B3J | |
| KEGG | C00011 D00004, C00011 | |
|
InChI
InChI=InChI=1S/CO2/c2-1-3
Key: CURLTUGMZLYLDI-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Gas incoloro | |
| Densidad | 1,976 kg/m³; 0,001976 g/cm³ | |
| Masa molar | 44,01 g/mol | |
| Punto de fusión | 194,7 K (−78 °C) | |
| Punto de ebullición | 216 K (−57 °C) | |
| Temperatura crítica | 304 K (31 °C) | |
| Presión crítica | 72.83 atm | |
| Estructura cristalina | Parecida al cuarzo | |
| Viscosidad | 0,07 cP a −78 °C | |
| Propiedades químicas | ||
| Acidez | 6,35 y 10,33 pKa | |
| Solubilidad en agua | 1,45 kg/m³ | |
| Momento dipolar | 0 D | |
| Termoquímica | ||
| ΔfH0gas | -393,52 kJ/mol | |
| S0gas, 1 bar | 213,79 J·mol–1·K | |
| Peligrosidad | ||
| NFPA 704 |
0
2
0
|
|
| Frases S | S9, S26, S36 (líquido) | |
| Riesgos | ||
| Ingestión | Puede causar irritación, náuseas, vómitos y hemorragias en el tracto digestivo. | |
| Inhalación | Produce asfixia, causa hiperventilación. La exposición a largo plazo es peligrosa. Asfixiante a grandes concentraciones | |
| Piel | En estado líquido puede producir congelación. | |
| Ojos | En estado líquido puede producir congelación. | |
| Compuestos relacionados | ||
| Compuestos relacionados | Monóxido de carbono Ácido carbónico |
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El dióxido de carbono (fórmula química CO2) es un compuesto de carbono y oxígeno. Es un gas incoloro en condiciones normales de temperatura y presión.
Antes de 2005, también se le conocía como anhídrido carbónico. Este compuesto está formado por un átomo de carbono unido a dos átomos de oxígeno mediante enlaces fuertes. El CO2 se encuentra de forma natural en la atmósfera de la Tierra. Es un gas traza, lo que significa que está presente en pequeñas cantidades. Su concentración actual es de alrededor del 0,04% (410 ppm). Esta cantidad es un 45% mayor que los niveles que había antes de la Revolución Industrial, que eran de 280 ppm.
El dióxido de carbono proviene de fuentes naturales como volcanes, aguas termales y géiseres. También se libera cuando ciertas rocas se disuelven en agua y ácidos. Como el CO2 se puede disolver en agua, lo encontramos en aguas subterráneas, ríos, lagos, campos de hielo, glaciares y mares. Además, está presente en yacimientos de petróleo y gas natural.
Contenido
- ¿Por qué es importante el dióxido de carbono para la vida?
- ¿Cómo se descubrió el dióxido de carbono?
- El dióxido de carbono en la atmósfera de los planetas
- Usos del dióxido de carbono en la industria
- Usos médicos del dióxido de carbono
- Dióxido de carbono como fuente de oxígeno
- ¿Cómo se detecta el dióxido de carbono?
- Ver también
- Véase también
¿Por qué es importante el dióxido de carbono para la vida?
El CO2 atmosférico es la principal fuente de carbono para la vida en la Tierra. Desde hace mucho tiempo, su cantidad en la atmósfera ha sido regulada por seres vivos y procesos geológicos.
Como parte del ciclo del carbono, las plantas, algas y cianobacterias usan la energía solar para hacer su propio alimento. Este proceso se llama Fotosíntesis. Para ello, usan CO2 y agua, y liberan oxígeno como desecho. Las plantas también producen CO2 cuando respiran por la noche.
El dióxido de carbono es un producto de la respiración de todos los organismos aerobios, que son los que necesitan oxígeno para vivir. Los peces lo liberan al agua a través de sus branquias. Los animales terrestres, como los humanos, lo liberan al aire a través de sus pulmones.
El CO2 también se produce cuando los materiales orgánicos se descomponen. Además, se forma durante la fermentación de azúcares, como en la fabricación de vino, cerveza y pan. También se produce al quemar madera (leña), carbohidratos y combustibles fósiles como el carbón, la turba, el petróleo y el gas natural.
La respiración celular (en las mitocondrias) se puede representar así: <chem display="block">C6H12O6 + 6O2 -> 6H2O + 6CO2 + 38ATP</chem>
¿Cómo se descubrió el dióxido de carbono?
El dióxido de carbono fue uno de los primeros gases que se identificó como una sustancia diferente al aire que respiramos. En el siglo XVII, el químico Jan Baptist van Helmont notó que al quemar carbón en un recipiente cerrado, la ceniza que quedaba pesaba mucho menos que el carbón original. Él pensó que el carbón se había convertido en una sustancia invisible a la que llamó "gas" o "espíritu silvestre".
En 1750, el médico escocés Joseph Black estudió más a fondo el dióxido de carbono. Descubrió que la piedra caliza (carbonato de calcio) producía un gas incoloro al calentarse o al mezclarse con ácidos. A este gas lo llamó "aire fijo". Black observó que este "aire fijo" era más pesado que el aire normal y que no permitía que las llamas ardieran ni que los animales vivieran. También notó que si se burbujeaba este gas a través de una solución de cal (hidróxido de calcio), se formaba un polvo blanco de carbonato de calcio. Este descubrimiento se usó después para demostrar que el dióxido de carbono se produce al respirar los animales y al fermentar los microbios.
En 1772, el químico inglés Joseph Priestley publicó un trabajo donde describía cómo producir dióxido de carbono. Lo hacía goteando ácido sulfúrico sobre tiza. Luego, forzaba al gas a disolverse en agua, agitando un recipiente con agua en contacto con el gas. Así inventó el agua carbonatada.
El dióxido de carbono fue convertido en líquido por primera vez en 1823 por Humphry Davy y Michael Faraday. La primera vez que se describió el dióxido de carbono en estado sólido fue en 1834. Charles Thilorier abrió un recipiente con dióxido de carbono líquido y descubrió que el enfriamiento rápido por la evaporación del líquido producía una "nieve" de dióxido de carbono sólido.
El dióxido de carbono en la atmósfera de los planetas
El dióxido de carbono en forma de gas se encuentra en las atmósferas de varios planetas de nuestro sistema solar. Por ejemplo, en Venus y Marte, sus atmósferas tienen más del 95% de CO2. En la Tierra, la concentración es mucho menor, alrededor del 0,042% (unas 421 ppm).
La cantidad de CO2 en la atmósfera de la Tierra ha cambiado a lo largo de la historia. En el periodo devónico, hace unos 400 millones de años, había una concentración muy alta, de unas 3000 ppm. En el periodo jurásico, hace 150 millones de años, los niveles superaron las 1700 ppm. Estas altas concentraciones se han relacionado con mucha actividad volcánica y temperaturas elevadas en esos tiempos.
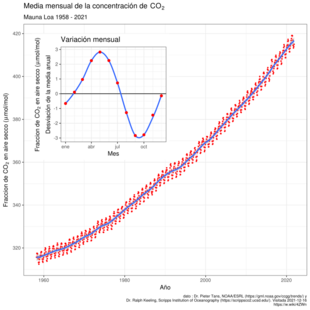
Actualmente, el dióxido de carbono es menos del 1% del volumen de la atmósfera de la Tierra. En 2018, su concentración promedio anual fue de 407,8 ppm. Esta concentración varía un poco a lo largo del año debido a los cambios en la cantidad de plantas en el hemisferio norte. Desde finales de la primavera hasta el final del verano, las plantas crecen más y usan más CO2, lo que reduce su concentración en el aire. En otoño e invierno, las plantas se detienen o mueren, usan menos CO2 y la concentración aumenta.
Las concentraciones también varían según la región. Son más altas en las ciudades y dentro de las casas pueden ser hasta 10 veces mayores que en el exterior.
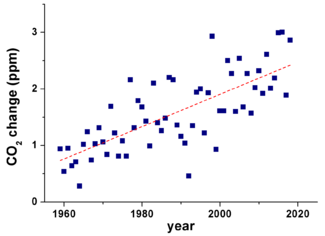
La quema de combustibles fósiles y la deforestación han causado un aumento de casi el 43% en la concentración de CO2 en la atmósfera desde el inicio de la Revolución Industrial. La mayor parte del dióxido de carbono de las actividades humanas proviene de la quema de carbón y otros combustibles fósiles. Otras actividades como la quema de biomasa y la producción de cemento también liberan CO2. Los volcanes emiten entre 0,2 y 0,3 mil millones de toneladas de CO2 al año, mientras que las actividades humanas emiten cerca de 29 mil millones de toneladas al año.
Dióxido de carbono y el efecto invernadero
El dióxido de carbono es un gas de efecto invernadero. Esto significa que absorbe y emite calor (radiación infrarroja). Este proceso hace que el dióxido de carbono caliente la superficie de la Tierra y la parte baja de la atmósfera, mientras que enfría la atmósfera superior.
El ejemplo más extremo de este efecto invernadero se ve en la atmósfera del planeta Venus. Allí, el 96,5% de la atmósfera es dióxido de carbono. Estas capas de gas, junto con ácido sulfúrico, calientan la atmósfera a una presión muy alta, creando temperaturas superficiales de cientos de grados Celsius.
En el planeta Marte, su atmósfera tiene más del 95,3% de CO2 en forma de gas. Debido a sus bajas temperaturas, también hay CO2 sólido en sus polos. A pesar de la gran cantidad de CO2, Marte no tiene un efecto invernadero fuerte. Esto se debe a que su atmósfera es muy delgada y no puede retener mucho calor.
En la Tierra, la mayoría de los científicos del clima están de acuerdo en que el aumento de CO2 en la atmósfera es la razón principal del aumento de la temperatura global desde mediados del siglo XX. Aunque el dióxido de carbono es el gas de efecto invernadero más importante, otros gases como el metano, el óxido nitroso y el ozono también contribuyen. El CO2 es el que más preocupa porque tiene un mayor impacto en el calentamiento y permanece en la atmósfera por mucho tiempo. Según el IPCC, más de la mitad del CO2 emitido tarda un siglo en desaparecer de la atmósfera, y cerca del 20% se queda por miles de años.
El aumento de CO2 no solo eleva la temperatura del planeta, sino que el aumento de las temperaturas también causa un aumento de las concentraciones de CO2. Esto crea un ciclo donde un cambio alimenta al otro. Hace quinientos millones de años, la concentración de dióxido de carbono era 20 veces mayor que la actual. Disminuyó a 4-5 veces durante el periodo Jurásico y luego bajó lentamente, con una reducción muy rápida hace 49 millones de años.
Las concentraciones de dióxido de carbono pueden ser muy altas en lugares específicos, especialmente si están aislados por el terreno. En las aguas termales de Bossoleto, en Italia, las concentraciones de CO2 suben más del 75% por la noche. Esto es suficiente para matar insectos y animales pequeños. Durante el día, el gas se dispersa con el aire. Grandes emisiones de CO2 desde el fondo de lagos profundos, saturados con este gas, causaron muertes en el Lago Monoun (Camerún) en 1984 y en el lago Nyos (Camerún) en 1986.
Usos del dióxido de carbono en la industria
El dióxido de carbono tiene muchos usos en la industria. A nivel mundial, se usa principalmente en pozos de petróleo para ayudar a extraer más crudo, sobre todo en Estados Unidos de América.
También se usa como extintor porque elimina el oxígeno, impidiendo que el fuego siga ardiendo.
En la industria alimentaria, se añade a las bebidas carbonatadas para darles burbujas y efervescencia.
Puede usarse como un ácido seguro y poco contaminante. Su acidez ayuda a cuajar productos lácteos más rápido y de forma más económica, sin cambiar el sabor. En la industria, se usa para neutralizar residuos alcalinos sin necesidad de ácidos más contaminantes.
En la agricultura, se puede usar como abono. Aunque las plantas no lo absorben por las raíces, se puede añadir para bajar el pH del suelo. Esto evita la acumulación de cal y hace que algunos nutrientes estén más disponibles para las plantas.
En invernaderos y cultivos de interior, se aumenta el CO2 en el ambiente quemando propano o gas natural, o inyectando CO2 líquido puro. Esto ayuda a que las plantas crezcan más y aumente la cosecha.
También se usa en refrigeración como un líquido refrigerante en máquinas de frío o congelado como hielo seco. Este mismo compuesto se usa para crear niebla artificial y efectos de "hervor" en el agua para el cine y espectáculos.
Otro uso creciente es como agente extractor en condiciones supercríticas. Esto es útil porque deja pocos o ningún residuo en los productos extraídos. Actualmente, se usa para obtener sustancias como la cafeína y ciertos pigmentos. Este método tiene un gran potencial, ya que permite extracciones en ambientes sin oxígeno, lo que ayuda a obtener productos con alto poder antioxidante. La temperatura y presión críticas del dióxido de carbono se pueden cambiar añadiendo otras sustancias. Esto es útil para ciertas aplicaciones, como su uso en ciclos termodinámicos para la generación de electricidad. La combinación de CO2 con estas sustancias se llama mezcla de dióxido de carbono supercrítica.
También se utiliza como material para generar luz coherente (en los láseres de CO2).
Junto con el agua, es uno de los disolventes más usados en procesos con fluidos supercríticos.
El dióxido de carbono es un producto que a veces no se desea en muchos procesos químicos grandes. Por ejemplo, en la oxidación de hidrocarburos para obtener otras sustancias. El dióxido de carbono es el producto que se forma más fácilmente en cualquier reacción de oxidación. Por eso, el desafío es encontrar un catalizador y condiciones que permitan producir el producto deseado y minimicen la formación de dióxido de carbono.
Usos médicos del dióxido de carbono
- Se usa para inflar el abdomen en cirugías laparoscópicas.
- Como sustancia para ver mejor los vasos sanguíneos en radiología.
- En láseres de CO2.
- Como ayuda para la ventilación mecánica en cirugías.
- En el tratamiento de heridas y úlceras.
- En tratamientos de belleza.
- En el tratamiento de problemas de circulación.
Dióxido de carbono como fuente de oxígeno
El vehículo espacial Perseverance llevó a Marte un aparato llamado MOXIE (Experimento ISRU de Oxígeno en Marte). Este dispositivo tiene como objetivo producir oxígeno a partir del dióxido de carbono de la atmósfera de Marte. Esta tecnología, que usa la electrólisis, podría ser importante en el futuro para mantener la vida humana o para crear combustible para cohetes en misiones de regreso. El MOXIE logró producir oxígeno a pequeña escala a partir del CO2 marciano. La reacción es:
-
- <chem>2CO2 -> 2CO + O2</chem>
¿Cómo se detecta el dióxido de carbono?
El dióxido de carbono en forma de gas se puede detectar usando agua de barita (Ba(OH)2). Cuando reacciona con ella, forma carbonato de bario, que es un precipitado blanco. Este precipitado no se disuelve si se añade más agua de barita, pero sí se disuelve en soluciones ácidas. Para medir la cantidad de dióxido de carbono, se usan métodos basados en ácidos y bases de forma indirecta, o métodos con instrumentos que usan luz infrarroja.
Ver también
- Alcalosis respiratoria
- Acidosis respiratoria
- pCO2
Véase también
 En inglés: Carbon dioxide Facts for Kids
En inglés: Carbon dioxide Facts for Kids