Número atómico para niños
En el mundo de la física y la química, el número atómico es un concepto muy importante. Nos dice cuántos protones tiene cada átomo de un elemento químico específico. Se representa con la letra "Z", que viene de la palabra alemana Atomzahl, que significa "número atómico".
Este número se escribe como un pequeño número abajo y a la izquierda del símbolo del elemento. Por ejemplo, el hidrógeno tiene 1 protón, así que su Z es 1. El helio tiene 2 protones, por lo que su Z es 2. Y el litio tiene 3 protones, con un Z de 3.
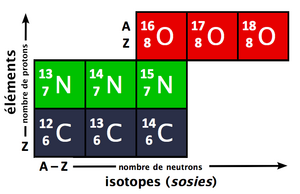
Los átomos de diferentes elementos tienen distintas cantidades de protones. Cuando un átomo está en su estado normal, es neutro. Esto significa que tiene la misma cantidad de electrones (partículas con carga negativa) que de protones (partículas con carga positiva). Por ejemplo, un átomo de sodio (Na) tiene un número atómico de 11. Esto significa que tiene 11 protones y 11 electrones. Un átomo de magnesio (Mg) tiene un Z de 12, con 12 protones y 12 electrones.
En 1913, un científico llamado Henry Moseley descubrió algo muy interesante. Notó una relación clara entre los rayos X que emitían los metales y el número atómico de esos metales. Este descubrimiento fue clave. Permitió organizar los elementos en la tabla periódica de una manera más precisa, basándose en su número atómico creciente.
Contenido
Historia del Número Atómico
¿Cómo se ordenaron los elementos al principio?

La idea de organizar los elementos en una tabla periódica surgió hace mucho tiempo. El químico ruso Dmitri Mendeléyev fue uno de los primeros en crear una tabla periódica en 1869. Él ordenó los elementos principalmente por su "peso atómico".
Sin embargo, Mendeléyev a veces cambiaba el orden si las propiedades químicas de los elementos no encajaban. Por ejemplo, puso el telurio (con un peso atómico de 127.6) antes que el yodo (con 126.9). En ese momento, no se sabía por qué, pero hoy sabemos que el orden correcto es por el número de protones (Z).
Más tarde, se encontraron otros pares de elementos, como el argón y el potasio, o el cobalto y el níquel, que tenían pesos atómicos muy parecidos o incluso invertidos. Esto hacía difícil saber dónde colocarlos en la tabla solo por su peso.
El modelo del átomo y la carga central
En 1911, Ernest Rutherford propuso un modelo del átomo. En este modelo, la mayor parte de la masa del átomo y toda su carga positiva se encontraban en un pequeño centro llamado núcleo. Rutherford pensó que esta carga positiva era aproximadamente la mitad del peso atómico del elemento.
Poco después, en 1911, Antonius van den Broek sugirió algo muy importante. Propuso que la carga positiva del núcleo y el número de electrones de un átomo eran exactamente iguales a su posición en la tabla periódica. Esta posición es lo que hoy conocemos como el número atómico (Z). Con el tiempo, se demostró que él tenía razón.
El experimento clave de Moseley en 1913
La idea de Van den Broek fue confirmada de forma espectacular por Henry Moseley en 1913. Moseley, trabajando con Niels Bohr, decidió investigar si las líneas de luz (rayos X) que emitían los átomos excitados se relacionaban con el número atómico.
Moseley midió las longitudes de onda de los rayos X que producían diferentes elementos, desde el aluminio (Z=13) hasta el oro (Z=79). Descubrió que la raíz cuadrada de la frecuencia de estos rayos X aumentaba de forma regular de un elemento a otro. Esto llevó a la ley de Moseley. Esta ley demostró que el número atómico (Z) de un elemento se corresponde directamente con la carga positiva de su núcleo. Gracias a Moseley, se pudo confirmar que el número atómico es el verdadero "identificador" de un elemento.
Elementos que faltaban en la tabla
Después del trabajo de Moseley, se pudo revisar la tabla periódica. Se identificaron siete elementos que aún no se habían descubierto, con números atómicos específicos (43, 61, 72, 75, 85, 87 y 91). Entre 1918 y 1947, estos elementos fueron encontrados. Además, se descubrieron los primeros elementos transuránicos, completando la tabla periódica hasta el curio (Z=96).
El descubrimiento del neutrón
Al principio, los científicos no entendían por qué la masa de los átomos era mayor de lo que esperaban si solo estaban hechos de protones. Se pensaba que el núcleo contenía "electrones nucleares" para neutralizar parte de la carga.
Sin embargo, todo esto cambió con el descubrimiento del neutrón por James Chadwick en 1932. Se descubrió que el núcleo de un átomo no solo tiene protones, sino también neutrones, que no tienen carga eléctrica. Por ejemplo, un átomo de oro (Z=79) tiene 79 protones y 118 neutrones, no 118 "electrones nucleares". Así, quedó claro que el número atómico (Z) es exactamente igual al número de protones en el núcleo de un átomo.
Números Atómicos en la Tabla Periódica
La tabla periódica organiza todos los elementos conocidos por su número atómico (Z), desde el 1 hasta el 118.
| H 1 |
He 2 |
||||||||||||||||
| Li 3 |
Be 4 |
B 5 |
C 6 |
N 7 |
O 8 |
F 9 |
Ne 10 |
||||||||||
| Na 11 |
Mg 12 |
Al 13 |
Si 14 |
P 15 |
S 16 |
Cl 17 |
Ar 18 |
||||||||||
| K 19 |
Ca 20 |
Sc 21 |
Ti 22 |
V 23 |
Cr 24 |
Mn 25 |
Fe 26 |
Co 27 |
Ni 28 |
Cu 29 |
Zn 30 |
Ga 31 |
Ge 32 |
As 33 |
Se 34 |
Br 35 |
Kr 36 |
| Rb 37 |
Sr 38 |
Y 39 |
Zr 40 |
Nb 41 |
Mo 42 |
Tc 43 |
Ru 44 |
Rh 45 |
Pd 46 |
Ag 47 |
Cd 48 |
In 49 |
Sn 50 |
Sb 51 |
Te 52 |
I 53 |
Xe 54 |
| Cs 55 |
Ba 56 |
* |
Hf 72 |
Ta 73 |
W 74 |
Re 75 |
Os 76 |
Ir 77 |
Pt 78 |
Au 79 |
Hg 80 |
Tl 81 |
Pb 82 |
Bi 83 |
Po 84 |
At 85 |
Rn 86 |
| Fr 87 |
Ra 88 |
** |
Rf 104 |
Db 105 |
Sg 106 |
Bh 107 |
Hs 108 |
Mt 109 |
Ds 110 |
Rg 111 |
Cn 112 |
Nh 113 |
Fl 114 |
Mc 115 |
Lv 116 |
Ts 117 |
Og 118 |
| * |
La 57 |
Ce 58 |
Pr 59 |
Nd 60 |
Pm 61 |
Sm 62 |
Eu 63 |
Gd 64 |
Tb 65 |
Dy 66 |
Ho 67 |
Er 68 |
Tm 69 |
Yb 70 |
Lu 71 |
||
| ** |
Ac 89 |
Th 90 |
Pa 91 |
U 92 |
Np 93 |
Pu 94 |
Am 95 |
Cm 96 |
Bk 97 |
Cf 98 |
Es 99 |
Fm 100 |
Md 101 |
No 102 |
Lr 103 |
||
¿Por qué el número atómico es tan importante para la química?
El número atómico (Z) es fundamental porque determina las propiedades químicas de un elemento. Esto se debe a que el número de protones (Z) en el núcleo es igual al número de electrones en un átomo neutro.
La forma en que estos electrones se organizan alrededor del núcleo (su configuración electrónica) es lo que define cómo reaccionará un elemento con otros. Especialmente, los electrones de la capa más externa (llamada capa de valencia) son los que participan en la formación de enlaces químicos. Por eso, el número atómico es la clave para entender el comportamiento de cada elemento.
Véase también
 En inglés: Atomic number Facts for Kids
En inglés: Atomic number Facts for Kids