Estructura de Lewis para niños
La estructura de Lewis es una forma sencilla de dibujar cómo se unen los átomos en una molécula y cómo se distribuyen sus electrones. Imagina que es como un mapa que nos muestra dónde están los electrones que forman los enlaces y los que no participan en ellos. También se le conoce como diagrama de Lewis o regla del octeto.
Este tipo de dibujo nos ayuda a entender cómo los átomos se conectan entre sí, ya sea con enlaces simples, dobles o triples. También nos da una idea de la forma que tendrá la molécula en el espacio.
En las estructuras de Lewis, los átomos se organizan para que su capa más externa de electrones se parezca a la de un gas noble. Esto significa que la mayoría de los átomos buscan tener ocho electrones en su última capa (como el oxígeno o el carbono), mientras que el hidrógeno solo necesita dos.
Para dibujar una estructura de Lewis, usamos el símbolo químico de cada átomo. Las líneas o pares de puntos entre los átomos representan los electrones que comparten para formar un enlace. Los electrones que no están enlazados (llamados "pares solitarios") se muestran como puntos o líneas alrededor del átomo al que pertenecen.
Este modelo fue creado por un científico llamado Gilbert Newton Lewis en 1916.
Contenido
¿Cómo se forman las moléculas en la estructura de Lewis?
Cuando dibujamos una molécula con el diagrama de Lewis, generalmente hay un átomo principal en el centro. Este átomo central suele ser el que puede formar más enlaces. Por ejemplo, el carbono a menudo es el átomo central porque es muy bueno para unirse con otros.
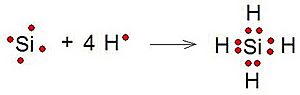
Si una molécula tiene varios átomos de un mismo tipo y solo uno de otro, el átomo diferente suele ser el central. Por ejemplo, en una molécula con cuatro átomos de hidrógeno y uno de silicio, el silicio sería el átomo central. El átomo central casi siempre es el menos electronegativo (el que atrae menos los electrones). El hidrógeno, en cambio, siempre se coloca en los extremos, nunca en el centro, porque solo puede formar un enlace.
Aquí te damos algunas reglas generales para saber qué átomo va en el centro y cuáles en los extremos:
- Hay dos tipos de átomos: los centrales y los terminales. Los centrales se unen a varios átomos terminales.
- Los átomos de hidrógeno siempre son terminales. Solo pueden formar un enlace.
- El carbono casi siempre es un átomo central.
- El oxígeno suele ser un átomo terminal, excepto en casos como el agua (<chem>H2O</chem>) o en grupos <chem>OH</chem>.
- Los halógenos (como el flúor o el cloro) generalmente son átomos terminales.
- En general, los átomos que atraen menos los electrones (menos electronegativos) son los centrales. Los que atraen más los electrones (más electronegativos) son los terminales.
A veces es un poco difícil saber cuál es el átomo central, especialmente cuando hay muchos átomos de diferentes tipos.
¿Qué son los electrones de valencia?
Los electrones de valencia son los electrones que se encuentran en la capa más externa de un átomo. Son los que participan en la formación de enlaces químicos.
Para dibujar una estructura de Lewis, primero sumamos todos los electrones de valencia de cada átomo en la molécula. Luego, los colocamos en el dibujo. Primero se ponen los pares de electrones que no están enlazados (pares solitarios). Después, si los átomos (especialmente los centrales) no tienen suficientes electrones para cumplir la regla del octeto, se forman enlaces compartiendo electrones. Cada enlace simple cuenta como dos electrones compartidos.
La mayoría de los compuestos orgánicos (los que tienen carbono) siguen la regla del octeto. Sin embargo, algunos compuestos, especialmente los que tienen elementos como el fósforo, el azufre, el yodo o el xenón, pueden tener más de ocho electrones en su capa externa. A estos se les llama compuestos "hipervalentes".
La teoría de Lewis se usa principalmente para los enlaces covalentes, donde los electrones se comparten. Pero también se puede aplicar a los compuestos iónicos, donde los electrones se transfieren de un átomo a otro. Cuando dibujamos la estructura de Lewis de un ion (un átomo o molécula con carga eléctrica), toda la estructura se encierra entre corchetes y la carga se escribe arriba a la derecha.
La regla del octeto: ¿Por qué es importante?
La regla del octeto dice que los átomos tienden a unirse para completar su capa de valencia, es decir, para tener ocho electrones en su última capa. Esto los hace estables, como los gases nobles.
Para lograr esta estabilidad, los átomos pueden ganar, perder o compartir electrones cuando forman enlaces químicos. Por ejemplo, los átomos de oxígeno se unen entre sí o con otros átomos para alcanzar esos ocho electrones, formando enlaces simples o dobles.
Al dibujar una estructura de Lewis, es importante recordar que cada enlace covalente simple aporta dos electrones a cada átomo que lo forma. Debemos asegurarnos de que cada átomo no tenga más de ocho electrones a su alrededor (con algunas excepciones).
Excepciones a la regla del octeto
Aunque la regla del octeto es muy útil, hay algunas excepciones importantes:
- El hidrógeno es una excepción clave. Solo tiene un orbital en su capa de valencia y solo puede aceptar un máximo de dos electrones. Por eso, el hidrógeno siempre busca tener dos electrones, no ocho.
- Algunos átomos, especialmente los que forman iones positivos (cationes), no siempre terminan con ocho electrones en su capa más externa. Esto sucede porque pierden electrones de su capa exterior, y la capa que queda por debajo ya está "completa" con ocho electrones (o dos, si es la primera capa). Por ejemplo, el sodio (Na) pierde un electrón y se queda con la misma configuración de electrones que el neón, que es un gas noble.
- Los átomos no metálicos a partir del tercer período de la tabla periódica (como el fósforo y el azufre) pueden tener "octetos expandidos". Esto significa que pueden tener más de ocho electrones en su capa de valencia, usando otros niveles de energía para acomodar los electrones extra.
Carga formal: El balance de electrones
La carga formal de un átomo en una estructura de Lewis nos ayuda a entender cómo se distribuyen los electrones y si la estructura es la más estable. Es como una forma de ver si un átomo tiene más o menos electrones de los que "debería" tener en esa estructura.
Para una molécula que no tiene carga (neutra), la suma de las cargas formales de todos sus átomos debe ser cero. Si es un ion, la suma de las cargas formales debe ser igual a la carga total del ion. Esto nos ayuda a elegir la mejor estructura de Lewis cuando hay varias opciones.
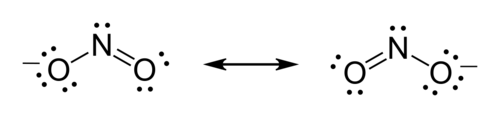
Ejemplo: Estructura de Lewis para el ion nitrito (<chem>NO2-</chem>)
Vamos a ver cómo se dibuja la estructura de Lewis para el ion nitrito, que tiene un átomo de nitrógeno y dos de oxígeno, con una carga negativa (-1).
- Paso uno: Escoger el átomo central. El nitrógeno es el átomo central porque solo hay uno y es el que puede formar más enlaces.
- Paso dos: Contar los electrones de valencia. El nitrógeno tiene 5 electrones de valencia. Cada oxígeno tiene 6. Así que, 5 + (2 × 6) = 17 electrones. Como el ion tiene una carga de -1, significa que tiene un electrón extra. Entonces, el total de electrones es 17 + 1 = 18 electrones.
- Paso tres: Ubicar los pares de electrones y cumplir la regla del octeto. Cada oxígeno se une al nitrógeno. Para que los tres átomos cumplan la regla del octeto (8 electrones cada uno), necesitaríamos 3 × 8 = 24 electrones. Como solo tenemos 18 electrones, la diferencia (24 - 18 = 6) nos dice cuántos electrones se comparten en enlaces. Esos 6 electrones forman 3 enlaces (6 / 2 = 3 pares).
- Paso cuatro: Electrones no enlazantes. Restamos los electrones enlazantes (6) del total de electrones (18): 18 - 6 = 12 electrones. Estos 12 electrones (6 pares) son los que no forman enlaces y se colocan alrededor de los átomos para que cumplan el octeto. Los dos átomos de oxígeno terminan con 8 electrones cada uno. El nitrógeno tiene 6 electrones enlazados y un par no enlazante.
- Paso cinco: Carga formal. Calculamos la carga formal para cada átomo. Para el nitrógeno, la carga formal es cero. Para uno de los oxígenos (el que tiene un enlace simple), la carga formal es -1. Para el otro oxígeno (el que tiene un enlace doble), la carga formal es cero. La suma de las cargas formales es 0 + (-1) + 0 = -1, que es la carga del ion. Finalmente, se encierra la estructura entre corchetes y se escribe la carga (-) arriba a la derecha. En este caso, el ion nitrito puede tener dos formas de dibujarse, llamadas estructuras de resonancia, donde los electrones se mueven.
Galería de imágenes
Véase también
 En inglés: Lewis structure Facts for Kids
En inglés: Lewis structure Facts for Kids