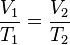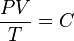Gas para niños
El gas es uno de los estados de la materia. En este estado, las moléculas de una sustancia están muy separadas entre sí y se mueven libremente. Por eso, un gas siempre toma la forma y el volumen del recipiente que lo contiene, y tiende a expandirse para ocupar todo el espacio disponible.
A la temperatura y presión normales de nuestro ambiente, algunos elementos que son gases son el hidrógeno, el oxígeno, el nitrógeno y los gases nobles. También hay compuestos como el dióxido de carbono o el propano, y mezclas como el aire.
Los vapores y el plasma tienen algunas características similares a los gases. Todos ellos se conocen como cuerpos gaseosos o estado gaseoso.
Contenido
- ¿Qué es un gas y cómo se comporta?
- ¿Cómo se estudian los gases?
- Gases reales: ¿Cuándo no son "ideales"?
- Aspectos importantes de los gases
- Cuestiones de seguridad con gases
- Galería de imágenes
- Véase también
¿Qué es un gas y cómo se comporta?
Los gases se diferencian de los sólidos y los líquidos porque no se pueden ver ni tocar fácilmente. Sin embargo, al igual que ellos, están hechos de átomos y moléculas.
La razón de las propiedades de los gases es que sus moléculas están muy separadas y se mueven de forma desordenada. Si un gas se enfría mucho, puede convertirse en líquido. Este proceso se llama condensación para los vapores y licuefacción para los gases. Por ejemplo, el oxígeno necesita una temperatura de -183 °C para volverse líquido.
Origen de la palabra "gas"
La palabra "gas" fue creada en el siglo XVII por el científico Jan Baptista van Helmont. Él la tomó del término griego kaos, que significa "desorden", para describir las características del dióxido de carbono. Con el tiempo, este nombre se usó para todos los cuerpos gaseosos.
Propiedades principales de los gases
Los gases se expanden porque sus moléculas interactúan muy poco entre sí y tienen mucha energía cinética (energía de movimiento). Son fluidos que se pueden comprimir mucho, lo que significa que su densidad cambia bastante con la presión y la temperatura.
Las moléculas de un gas casi no se atraen entre sí. Por eso, se mueven a gran velocidad en el espacio, muy separadas. Esto explica sus propiedades:
- Las moléculas de un gas están casi libres y pueden distribuirse por todo el espacio que las contiene. Las fuerzas de atracción entre ellas son muy pequeñas comparadas con la velocidad a la que se mueven.
- Los gases ocupan por completo el volumen del recipiente que los contiene.
- Los gases no tienen una forma definida; adoptan la forma del recipiente.
- Se pueden comprimir fácilmente porque hay mucho espacio vacío entre sus moléculas.
¿Cómo se estudian los gases?
Para entender cómo se comportan los gases, los científicos suelen observar sus propiedades a gran escala (macroscópica) o a pequeña escala (microscópica).
Comportamiento macroscópico de los gases
Cuando observamos un gas a gran escala, medimos propiedades como la presión, el volumen y la temperatura de una gran cantidad de partículas de gas. Estas mediciones nos dan el comportamiento "promedio" del gas.
Por ejemplo, el científico Robert Boyle estudió cómo la presión y el volumen de un gas se relacionan. Descubrió que si mantienes la temperatura y la cantidad de gas constantes, cuando aumentas la presión, el volumen del gas disminuye. Y si multiplicas la presión por el volumen, el resultado es siempre el mismo. Esta relación se conoce como la Ley de Boyle (PV = k).
Leyes fundamentales de los gases
Desde el siglo XVII, los científicos han desarrollado leyes que explican cómo se relacionan la presión, el volumen y la temperatura de un gas. Estas leyes son muy útiles para entender el comportamiento de los gases.
Ley de Boyle-Mariotte: Presión y volumen
Esta ley, formulada por Robert Boyle y Edme Mariotte, dice que si la temperatura y la cantidad de gas se mantienen constantes, el volumen de un gas es inversamente proporcional a su presión. Esto significa que si la presión aumenta, el volumen disminuye, y viceversa. Se expresa así:

Donde 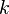 es una constante. Si comparamos dos situaciones, se cumple:
es una constante. Si comparamos dos situaciones, se cumple:

Donde P es la presión y V es el volumen en los momentos 1 y 2.
Ley de Charles: Volumen y temperatura
Esta ley establece que, a una presión constante, el volumen de una cantidad de gas es directamente proporcional a su temperatura (medida en Kelvin). Esto significa que si la temperatura aumenta, el volumen también aumenta. Se expresa así:
Ley de Gay-Lussac: Presión y temperatura
Esta ley dice que, si el volumen y la cantidad de gas se mantienen constantes, la presión de un gas es directamente proporcional a su temperatura (en Kelvin). Si la temperatura sube, la presión también sube. Se expresa así:
- Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \frac{P_1}{T_1}=\frac{P_2}{T_2}
Por eso, para almacenar gases como el gas licuado, primero se enfrían para poder someterlos a la presión necesaria sin que se sobrecalienten y causen problemas.
Ley general de los gases
Al combinar las tres leyes anteriores, obtenemos una ley general que relaciona la presión, el volumen y la temperatura de un gas:
Ley de los gases ideales
Esta es una de las leyes más importantes y se deriva de la ley general. Su fórmula es:
Aquí, 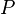 es la presión,
es la presión, 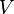 el volumen,
el volumen, 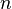 el número de moles (una forma de medir la cantidad de sustancia),
el número de moles (una forma de medir la cantidad de sustancia), 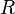 es una constante universal para los gases, y
es una constante universal para los gases, y 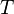 es la temperatura en Kelvin. Esta ley nos dice que un mol de gas ideal (una cantidad específica de moléculas) ocupa siempre el mismo volumen bajo ciertas condiciones de presión y temperatura.
es la temperatura en Kelvin. Esta ley nos dice que un mol de gas ideal (una cantidad específica de moléculas) ocupa siempre el mismo volumen bajo ciertas condiciones de presión y temperatura.
Comportamiento microscópico de los gases
Si pudiéramos ver las partículas de un gas con un microscopio muy potente, las veríamos moviéndose de forma aleatoria. Solo cambian de dirección cuando chocan con otra partícula o con las paredes del recipiente. Si estos choques fueran perfectamente elásticos (sin pérdida de energía), hablaríamos de un gas ideal.
Teoría cinética de los gases
Esta teoría nos ayuda a entender las propiedades de los gases a gran escala, observando cómo se mueven sus moléculas. Por ejemplo, si calentamos un recipiente sellado con gas, las partículas se mueven más rápido. Esto hace que choquen más veces y con más fuerza contra las paredes, lo que aumenta la presión. La temperatura que medimos es una forma de cuantificar la energía de movimiento de esas partículas.
Movimiento browniano
El movimiento browniano es un modelo matemático que describe el movimiento aleatorio de partículas muy pequeñas suspendidas en un fluido. En los gases, este movimiento aleatorio de las partículas hace que los gases se mezclen y se dispersen (difusión).
Fuerzas entre moléculas
Cuando un gas se comprime, las fuerzas de atracción o repulsión entre sus moléculas, llamadas fuerzas de Van der Waals, empiezan a ser más importantes. Estas fuerzas influyen en propiedades como la viscosidad del gas. Si estas fuerzas son muy pequeñas, podemos tratar un gas real como si fuera un gas ideal. Sin embargo, en condiciones extremas, como presiones muy altas o temperaturas muy bajas, estas fuerzas son más significativas y el gas se comporta de manera menos "ideal".
Gases reales: ¿Cuándo no son "ideales"?
Los gases "ideales" son un modelo simplificado. En la realidad, los gases se llaman gases reales y no se expanden infinitamente. Llega un punto en que no ocupan más volumen porque existen pequeñas fuerzas de atracción entre sus partículas (átomos o moléculas), llamadas fuerzas de Van der Waals.
Un gas se comporta más como un gas ideal cuanto más sencilla es su fórmula química y menos reactivo es (menos tiende a formar enlaces). Por ejemplo, los gases nobles (como el helio) se parecen mucho a los gases ideales. Los gases con moléculas más grandes o más complejas, como el dióxido de carbono o el butano, se alejan más del comportamiento ideal.
También se pierde la "idealidad" en condiciones extremas, como presiones muy altas o temperaturas muy bajas. Por el contrario, a bajas presiones o altas temperaturas, los gases se comportan de forma más parecida a un gas ideal.
Aspectos importantes de los gases
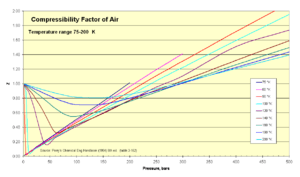
Compresibilidad
La compresibilidad es una medida de cuánto cambia el volumen de un gas cuando se le aplica presión. En termodinámica, se usa un factor "Z" para ajustar la ecuación del gas ideal y tener en cuenta cómo se comprimen los gases reales. Este factor suele estar muy cerca de 1.
Viscosidad
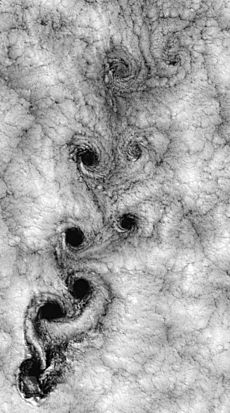
La viscosidad es una propiedad física que mide qué tan bien se "pegan" las moléculas de un fluido entre sí. Aunque los gases tienen una viscosidad menor que los líquidos, sigue siendo una propiedad importante. Por ejemplo, si los gases no tuvieran viscosidad, no se adherirían a la superficie de un ala de avión y no se formaría una capa de aire que permite el vuelo.
Turbulencia
En el movimiento de los fluidos, la turbulencia es un tipo de flujo caracterizado por cambios rápidos y desordenados en las propiedades del gas, como la presión y la velocidad. Puedes ver ejemplos de turbulencia en el aire, como en los patrones de nubes.
Capa límite
Las partículas de un gas se "pegan" a la superficie de un objeto que se mueve a través de él. Esta capa de partículas se llama capa límite. En la superficie del objeto, esta capa está casi quieta debido a la fricción. El objeto, junto con su capa límite, es lo que el resto de las moléculas de gas "ven" al acercarse. Esta capa puede separarse de la superficie, cambiando la forma en que el gas fluye alrededor del objeto.
Equilibrio termodinámico
Cuando un sistema (como un gas en un recipiente) deja de intercambiar energía con su entorno, se dice que está en equilibrio termodinámico. Esto significa que el sistema y su entorno tienen la misma temperatura, las fuerzas externas están equilibradas y no hay cambios químicos importantes.
Cuestiones de seguridad con gases
Fugas de gas
Los escapes de un gas inflamable de su recipiente son peligrosos. Si un gas inflamable entra en contacto con una llama o una chispa, podría causar una explosión o un incendio.
Gases inflamables comunes
Algunos gases inflamables que usamos o conocemos son:
- Gases usados como combustible para producir calor, como el butano, el propano y el gas natural.
- Gases usados como combustible para vehículos.
- Gases "Bio" o renovables usados como combustible.
- Gases usados para alumbrar.
- Muchos gases industriales, cuya inflamabilidad puede variar.
- Gases que se producen en reacciones de combustión, como el monóxido de carbono.
- Gases que se desprenden de la descomposición de sustancias orgánicas, como los gases de los vertederos.
Galería de imágenes
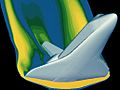
-
Modelo del flujo de gases alrededor del transbordador espacial en su fase de reentrada a la atmósfera de la Tierra.
Véase también
 En inglés: Gas Facts for Kids
En inglés: Gas Facts for Kids