Bario para niños
Datos para niños Cesio ← Bario → Lantano |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Bario, Ba, 56 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Metales alcalinotérreos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 2, 6, s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 137,327 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Xe] 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Mohs | 1,25 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 18, 8, 2 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Blanco plateado | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 215 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 0,89 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 253 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 198 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óxido | base fuerte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 502,9 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 965,2 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª energía de ionización | 3600 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido (paramagnético) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 3620 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 1000 K (727 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 2118 K (1845 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 142 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 7,75 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 98 Pa a 371 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Cúbica centrada en el cuerpo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 204 J/(kg·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | 3·106 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 18,4 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 1620 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del bario | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El bario es un elemento químico que se encuentra en la tabla periódica. Su símbolo es Ba y su número atómico es 56. Es un Metal alcalinotérreo, lo que significa que es un metal muy reactivo.
El bario es el elemento número 18 más común en la corteza terrestre. Forma una pequeña parte de ella, aproximadamente una de cada 2000 partes. Su masa atómica es de 137,327 unidades. Se derrite a 725 °C y hierve a 1640 °C. Su densidad es de 3,5 veces la del agua.
El nombre "bario" viene de una palabra griega que significa "pesado". Esto se debe a que muchos de sus compuestos son bastante densos. El bario fue descubierto como un nuevo elemento en 1772. Sin embargo, no se pudo obtener como metal puro hasta 1808. Esto fue posible gracias a un proceso llamado electrólisis.
Contenido
Bario: Un Elemento Químico Interesante
El bario tiene varias aplicaciones en la industria y la vida diaria. Históricamente, se usaba en tubos de vacío para ayudar a mantenerlos limpios. También se usaba en los cátodos de algunos aparatos electrónicos.
¿Para Qué se Usa el Bario?
El bario es un componente importante en algunos materiales especiales. Por ejemplo, forma parte del YBCO, que son materiales superconductores de alta temperatura. También se usa en electrocerámica.
Usos en la Metalurgia
Cuando se añade bario al acero y al hierro fundido, ayuda a que los granos de carbono sean más pequeños. Esto mejora las propiedades de estos metales.
Usos en la Pirotecnia
Los compuestos de bario son famosos por dar un color verde brillante a los fuegos artificiales. Esto los hace muy populares en espectáculos de luces.
Usos en la Perforación de Pozos
El sulfato de bario es un material muy denso. Por eso, se usa como un aditivo en el fluido de perforación para pozos de petróleo. Ayuda a controlar la presión dentro del pozo.
Usos en la Medicina
Una forma muy pura de sulfato de bario se usa en la medicina. Se utiliza como un agente de contraste para Rayos X. Esto permite a los médicos ver el tracto gastrointestinal de las personas en las imágenes de rayos X.
Otros Usos Importantes
- El bario metálico se usa a veces para cubrir cables eléctricos en aparatos electrónicos. También se encuentra en los sistemas de encendido de los automóviles.
- El carbonato de bario se usa para controlar algunas plagas.
- El sulfato de bario también se usa como material de relleno en productos de caucho, pintura y linóleo.
- El óxido de bario (BaO) se usa para fabricar lentes de vidrio de alta calidad. Estas lentes se emplean en instrumentos ópticos.
- El titanio de bario se usa en la fabricación de micrófonos cerámicos. Funciona como un cristal piezoeléctrico, que convierte el sonido en señales eléctricas.
- La ferrita hexagonal de bario se usa en materiales compuestos para mejorar sus propiedades magnéticas.
¿Cómo se Comporta el Bario?
El bario es un metal muy activo. Se parece al calcio en sus propiedades químicas, pero es aún más reactivo.
Propiedades Físicas del Bario
El bario es un metal de color plateado. Es un sólido frágil y blando. No tiene olor.
- Punto de Ebullición: 1869,85 °C
- Punto de Fusión: 726,85 °C
- Densidad: 3,62 gramos por centímetro cúbico (g/cm³)
Una característica interesante es que las sales de bario, cuando se calientan con una llama, producen un color verde intenso. Este efecto se debe a un salto cuántico de los electrones del bario.
Propiedades Químicas del Bario
El bario reacciona fácilmente con el cobre. También se oxida muy rápido cuando está en contacto con el agua. Es tan reactivo que no se encuentra solo en la naturaleza. Siempre está combinado con otros elementos.
Cuando el bario se expone al aire o al oxígeno, no solo forma óxido de bario (BaO), sino también peróxido. Reacciona fuertemente con el agua o el etanol (alcohol), liberando hidrógeno gaseoso.
La Historia del Bario
Algunos minerales de bario ya eran conocidos por los alquimistas en la Edad Media. Por ejemplo, unas piedras encontradas en Bolonia, Italia, llamadas "piedras de Bolonia", eran famosas. Estas piedras brillaban en la oscuridad después de haber estado expuestas a la luz.
Carl Scheele fue quien identificó que la baritina (sulfato de bario) contenía un nuevo elemento en 1774. Sin embargo, no pudo obtener el bario puro, solo su óxido. Dos años después, Johan Gottlieb Gahn también aisló el óxido de bario.
El óxido de bario fue llamado primero "barota". Luego, Antoine Lavoisier le cambió el nombre a "baryta". Este nombre viene del griego "barys", que significa "pesado", por la alta densidad de sus compuestos.
El bario fue aislado por primera vez en 1808 por Humphry Davy en Inglaterra. Lo logró usando electrólisis con sales de bario fundidas. Davy le dio el nombre de "barium" (bario) siguiendo la misma lógica que usó para el calcio.
¿Dónde Encontramos el Bario?
El bario es el 18º elemento más abundante en la corteza terrestre. Se encuentra en una concentración de 0,0425%. En el agua de mar, hay unos 13 microgramos por litro.
La principal fuente de bario es un mineral llamado baritina (o espato pesado). Este mineral es sulfato de bario y se encuentra en muchos lugares del mundo. Otro mineral, menos común, es la witherita, que es carbonato de bario.
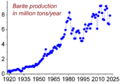
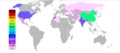
Los países que más producen barita son China, India, Marruecos y Estados Unidos. El mineral se extrae, se lava y se tritura. Luego, se separa de otras rocas como el cuarzo. El resultado es barita con una pureza de al menos el 95%.
Para obtener bario metálico, la barita se calienta con carbono. Esto produce sulfuro de bario. A partir del sulfuro de bario, se pueden obtener otros compuestos de bario. El bario metálico puro se obtiene calentando óxido de bario con aluminio a 1100 °C. El vapor de bario que se forma se recoge en moldes.
El Bario como Gema
Existe un mineral de bario muy raro llamado benitoita. Es un silicato de titanio y bario. Se encuentra como una piedra preciosa de color azul brillante que brilla bajo la luz ultravioleta. Es la gema oficial del estado de California.
El Bario en el Agua de Mar
El bario se encuentra en el agua de mar como un ion llamado Ba2+. Su concentración es bastante constante en la parte superior del océano. También existe en el océano como barita (BaSO4). El bario permanece en el océano por mucho tiempo, unos 10.000 años.
Galería de imágenes
Véase también
 En inglés: Barium Facts for Kids
En inglés: Barium Facts for Kids