Proceso de Haber para niños
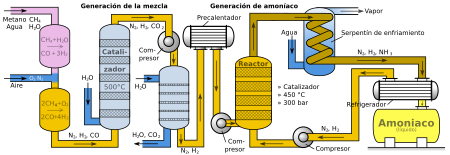
El proceso de Haber o proceso de Haber-Bosch es un método muy importante en la química que nos permite fabricar amoniaco. El amoniaco es un compuesto químico hecho de nitrógeno e hidrógeno en forma de gases. La importancia de este proceso radica en que es la forma principal de producir amoniaco a gran escala para la industria.
Alrededor del 78% del aire que respiramos es nitrógeno molecular (N₂). Esta molécula de nitrógeno es muy estable y no reacciona fácilmente con otras sustancias. Esto se debe a un enlace triple muy fuerte que une a sus dos átomos. Fue a principios del siglo XX cuando se desarrolló este proceso para tomar el nitrógeno del aire y convertirlo en amoniaco. El amoniaco, a su vez, puede transformarse en nitritos y nitratos. Estos son esenciales para fabricar ácido nítrico y fertilizantes, como el nitrato de amonio.
Como la reacción natural para formar amoniaco es muy lenta, se acelera usando un catalizador. Este catalizador suele ser de hierro (Fe³⁺) junto con óxidos de aluminio (Al₂O₃) y potasio (K₂O). El catalizador ayuda a que la reacción alcance su equilibrio más rápido. Para que se produzca más amoniaco, se usan condiciones de alta presión (entre 150 y 300 atmósferas) y altas temperaturas (entre 200 y 300 °C). Con estas condiciones, se logra convertir entre el 10% y el 20% de los gases en amoniaco.
La reacción química principal es:
El símbolo ΔH representa la energía que se libera o se absorbe en la reacción, también llamada entalpía. En este caso, es de -46,2 kJ por mol. Como el valor es negativo, significa que la reacción libera calor, por lo que se dice que es una reacción exotérmica.
Contenido
Historia del Proceso Haber-Bosch
¿Quiénes desarrollaron el proceso?
El químico alemán Fritz Haber fue quien desarrolló este proceso por primera vez. Más tarde, en 1910, Carl Bosch logró adaptar el proceso para producir amoniaco a gran escala, lo que lo hizo viable para la industria. Por sus importantes trabajos y avances en la aplicación de la tecnología de altas presiones y temperaturas, Haber recibió el Premio Nobel de Química en 1918, y Bosch lo recibió en 1931.
Uso del amoniaco en la Primera Guerra Mundial
Durante la Primera Guerra Mundial, el amoniaco producido con el proceso Haber fue muy importante. Se utilizó para fabricar nitratos, que eran necesarios para crear diversos productos químicos. Esto permitió que Alemania pudiera obtener estos materiales sin depender de los suministros de nitrato que venían de Chile, los cuales estaban bloqueados por otros países.
Impacto del Proceso Haber-Bosch
Beneficios económicos y para la alimentación
El proceso Haber-Bosch es increíblemente importante para la economía mundial y para alimentar a la población. Cada año, se producen más de 100 millones de toneladas de fertilizantes de nitrógeno gracias a este método. Se calcula que este proceso es responsable de ayudar a sustentar a más de un tercio de la población mundial. Esto se debe a que la agricultura y la ganadería extraen muchos nutrientes del suelo, y los fertilizantes ayudan a reponerlos de forma artificial, permitiendo que los cultivos crezcan mejor.
Sin embargo, la producción de amoniaco requiere mucha energía. Se estima que el 8.27% del consumo total de energía del mundo en un año se utiliza para este proceso.
Efectos en el medio ambiente
Aunque los fertilizantes son vitales, su uso incorrecto puede causar problemas ambientales. Por ejemplo, si se usan demasiados fertilizantes, los nutrientes pueden ser arrastrados por la lluvia hacia ríos y mares. Esto puede causar un problema llamado eutrofización.
¿Qué es la eutrofización?
La eutrofización ocurre cuando hay un exceso de nutrientes en el agua. Esto provoca un crecimiento descontrolado de algas y bacterias. Estas algas y bacterias consumen mucho oxígeno del agua, lo que deja a otras especies acuáticas sin el oxígeno que necesitan para vivir.
Otros impactos ambientales
Solo una parte del amoniaco usado como fertilizante es absorbido por las plantas y llega a los humanos a través de la comida. El resto puede terminar en la tierra o en el aire. Las emisiones de nitrógeno reactivo están alterando el equilibrio natural del nitrógeno en la atmósfera. Esto puede afectar la capa de ozono, aumentando el ozono en la troposfera (la parte más baja de la atmósfera) y reduciéndolo en la estratosfera (una capa más alta).
A pesar de estos desafíos, el amoniaco también tiene un efecto positivo. Una mayor presencia de nitrógeno en el aire puede ayudar a las selvas y bosques a capturar más dióxido de carbono (CO₂), lo que es beneficioso para el medio ambiente.
Véase también
 En inglés: Haber process Facts for Kids
En inglés: Haber process Facts for Kids