Berkelio para niños
Datos para niños Curio ← Berkelio → Californio |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
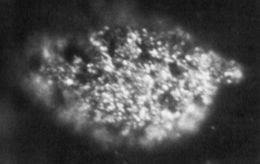 Una micrografía de la primera muestra aislada (1.7 µg) de Berkelio.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Berkelio, Bk, 97 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Actínidos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | Actínidos, 7, f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 247 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Rn] 5f9 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 32, 27, 8, 2 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Blanco frágil | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1.3 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 297 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de van der Waals | 1700 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | +2, +3, +4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 601 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 14790 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 1219 K (946 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 2627 K (2354 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 310 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Hexagonal compacta | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del berkelio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El berkelio es un elemento químico creado por el ser humano, que no se encuentra de forma natural en la Tierra. Su símbolo en la tabla periódica es Bk y su número atómico es 97. Pertenece a la familia de los actínidos, que son elementos pesados y radiactivos.
El berkelio fue descubierto en 1949 por los científicos S. G. Thompson, A. Ghiorso y G. T. Seaborg en el Laboratorio de Radiación de la Universidad de California, en Berkeley. Por eso, su nombre es un homenaje a esta ciudad. Fue el quinto elemento creado por el ser humano después del neptunio, plutonio, curio y americio.
El isótopo más común del berkelio es el berkelio-249. Se produce en cantidades muy pequeñas en reactores nucleares especiales, como los del Oak Ridge National Laboratory en Estados Unidos y el Research Institute of Atomic Reactors en Rusia. Para obtener otro isótopo, el berkelio-247, se bombardea un isótopo raro de curio (curio-244) con partículas alfa de alta energía.
Desde 1967, la cantidad total de berkelio producida en Estados Unidos es de apenas un gramo. Por esta razón, el berkelio no tiene usos prácticos fuera de la investigación científica. Se utiliza principalmente para crear elementos aún más pesados. Por ejemplo, en 2009, se usaron 22 miligramos de berkelio-249 para crear por primera vez el elemento ununseptio en Rusia. Esto fue parte de una colaboración entre científicos de Rusia y Estados Unidos.
El berkelio es un metal radiactivo, de color blanco plateado y bastante blando. El isótopo berkelio-249 emite partículas de baja energía, lo que lo hace relativamente seguro de manejar. Sin embargo, con el tiempo, se transforma en californio-249, que es mucho más radiactivo y peligroso. Esta transformación dificulta su estudio, ya que el californio-249 contamina las muestras y genera calor debido a su radiactividad.
Contenido
¿Cómo es el Berkelio?
Propiedades Físicas del Berkelio
El berkelio es un metal radiactivo, suave y de color blanco plateado. En la tabla periódica, se encuentra entre el curio y el californio. También se parece mucho al terbio en sus características.
Su densidad es de 14,78 gramos por centímetro cúbico, un valor intermedio entre el curio y el californio. Su punto de fusión es de 986 °C, lo que significa que se derrite a una temperatura muy alta. El berkelio es bastante blando y no es fácil de comprimir.
Cuando los iones de berkelio(III) se iluminan, emiten una luz especial. Se ven dos brillos intensos: uno rojo y otro rojo oscuro (casi infrarrojo). La fuerza de estos brillos cambia según la energía de la luz que se use y la temperatura del berkelio.
El berkelio tiene propiedades magnéticas interesantes. A temperaturas normales, se comporta como un material paramagnético. Esto significa que es atraído débilmente por un campo magnético. Pero si se enfría a unos -239 °C (34 K), se vuelve antiferromagnético, lo que cambia su comportamiento magnético.
Formas del Berkelio (Alótropos)
El berkelio puede existir en diferentes formas cristalinas, llamadas alótropos, dependiendo de la presión y la temperatura.
- A temperatura ambiente y presión normal, el berkelio tiene una forma llamada alfa (α-berkelio). Sus átomos se organizan en un patrón hexagonal.
- Si se le aplica mucha presión (7 GPa), el α-berkelio se transforma en una forma beta (β-berkelio). En esta forma, los átomos se organizan en un patrón cúbico.
- Con aún más presión (25 GPa), el berkelio cambia a una tercera forma, la gamma (γ-berkelio), que se parece al uranio. En este cambio, los electrones del berkelio se mueven de manera diferente.
Cuando el α-berkelio se calienta, también puede cambiar a una forma cúbica. Sin embargo, esta forma no es estable y con el tiempo vuelve a ser α-berkelio a temperatura ambiente.
Propiedades Químicas del Berkelio
El berkelio, como otros actínidos, se disuelve en ácidos. Al hacerlo, libera hidrógeno y forma iones de berkelio(III). Esta forma (+3) es la más estable, especialmente en líquidos. También existen compuestos de berkelio con valencia +4, y es posible que existan con valencia +2, aunque esto último no está del todo confirmado.
Las soluciones de iones de berkelio(III) suelen ser de color verde. Los iones de berkelio(IV) son amarillos en ácido clorhídrico y naranja-amarillos en ácido sulfúrico.
El berkelio no reacciona rápidamente con el oxígeno del aire a temperatura ambiente. Esto se debe a que forma una capa protectora de óxido en su superficie. Sin embargo, sí reacciona con otros elementos como el hidrógeno, halógenos y otros metales cuando está fundido, formando diferentes compuestos.
¿Dónde se encuentra el Berkelio?
Todos los isótopos de berkelio tienen una vida muy corta. Esto significa que cualquier berkelio que pudiera haber existido cuando la Tierra se formó ya se ha descompuesto. Por lo tanto, no se encuentra berkelio de forma natural en nuestro planeta.
El berkelio se ha encontrado en lugares donde hubo pruebas de armas nucleares entre 1945 y 1980. También se ha detectado en sitios de accidentes nucleares, como el desastre de Chernóbil. Por ejemplo, después de la primera prueba de una arma termonuclear en 1952, se encontraron altas cantidades de berkelio en los restos.
Los reactores nucleares producen principalmente el isótopo berkelio-249. Sin embargo, antes de que el combustible nuclear se deseche, la mayor parte de este berkelio se convierte en californio-249. Este último tiene una vida media más larga (351 años), lo cual no es bueno para el almacenamiento de residuos.
Curiosamente, se cree que elementos como el berkelio existieron de forma natural en el reactor nuclear natural de Oklo hace mucho tiempo, pero ya no están presentes.
El berkelio es uno de los elementos que se han detectado en la Estrella de Przybylski, una estrella muy especial que contiene muchos elementos raros.
Véase también
 En inglés: Berkelium Facts for Kids
En inglés: Berkelium Facts for Kids