Equilibrio químico para niños
El equilibrio químico es un estado especial en las reacciones químicas. Imagina que tienes una reacción donde las sustancias iniciales (llamadas reactivos) se transforman en nuevas sustancias (llamadas productos). En el equilibrio químico, la cantidad de reactivos y productos deja de cambiar.
Esto ocurre porque la reacción no se detiene. En realidad, la reacción va hacia adelante (de reactivos a productos) y también hacia atrás (de productos a reactivos) al mismo tiempo. Cuando la velocidad de la reacción hacia adelante es igual a la velocidad de la reacción hacia atrás, decimos que el sistema está en equilibrio dinámico. Esto significa que, aunque las moléculas siguen reaccionando, no hay un cambio neto en las cantidades de las sustancias.

Contenido
¿Qué es el Equilibrio Químico?
Cuando mezclamos sustancias químicas en un recipiente, no siempre todos los reactivos se convierten en productos. Después de un tiempo, las reacciones que van en direcciones opuestas pueden alcanzar la misma velocidad. En ese momento, se establece un equilibrio dinámico. La proporción entre los reactivos y los productos se mantiene fija.
El concepto de equilibrio químico fue descubierto por un científico llamado Berthollet en 1803. Él notó que algunas reacciones químicas pueden ir en ambos sentidos.
Imagina una reacción como esta:
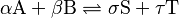
Las flechas que apuntan en ambas direcciones ( ) nos dicen que la reacción es reversible. Para que haya equilibrio, la velocidad con la que A y B se convierten en S y T debe ser igual a la velocidad con la que S y T se convierten de nuevo en A y B.
) nos dicen que la reacción es reversible. Para que haya equilibrio, la velocidad con la que A y B se convierten en S y T debe ser igual a la velocidad con la que S y T se convierten de nuevo en A y B.
- A y B son los reactivos (sustancias iniciales).
- S y T son los productos (sustancias finales).
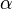 ,
, 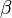 ,
, 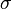 y
y 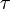 son números que indican cuántas moléculas de cada sustancia participan en la reacción.
son números que indican cuántas moléculas de cada sustancia participan en la reacción.
Si en el equilibrio casi todos los reactivos se han usado para formar productos, decimos que el equilibrio está "desplazado a la derecha". Si, por el contrario, se forma muy poco producto, el equilibrio está "desplazado a la izquierda".
La Constante de Equilibrio
Dos científicos, Guldberg y Waage, propusieron en 1864 una forma de describir el equilibrio. Ellos dijeron que la velocidad de una reacción depende de la cantidad de las sustancias que reaccionan.
Cuando las velocidades de la reacción directa (hacia los productos) y la inversa (hacia los reactivos) son iguales, podemos establecer una relación. Esta relación se llama constante de equilibrio (representada con la letra K).
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): K=\frac{\{S\}^\sigma \{T\}^\tau } {\{A\}^\alpha \{B\}^\beta}
Por lo general, las cantidades de los productos van arriba (en el numerador) y las de los reactivos van abajo (en el denominador). La constante de equilibrio (K) es un número que nos dice dónde está el equilibrio. Un valor grande de K significa que hay muchos productos en el equilibrio, y un valor pequeño significa que hay muchos reactivos.
Es importante saber que un catalizador (una sustancia que acelera las reacciones) no cambia la constante de equilibrio. Solo hace que la reacción alcance el equilibrio más rápido.
Equilibrio Dinámico en Acción
Aunque las cantidades de las sustancias en equilibrio parecen fijas, a nivel molecular las reacciones siguen ocurriendo. Por ejemplo, en una solución de ácido acético en agua:

Una molécula de ácido acético puede pasar un protón al agua, formando un ion acetato y un ion hidronio. Pero al mismo tiempo, un ion hidronio puede pasar un protón a un ion acetato para formar de nuevo ácido acético. El número total de moléculas de ácido acético se mantiene igual. ¡Es como un baile constante de moléculas!
El Principio de Le Châtelier
El Principio de Le Châtelier, propuesto en 1884, es una regla muy útil. Nos ayuda a predecir qué pasará si cambiamos las condiciones de un sistema en equilibrio.
Dice así: Si perturbas un sistema en equilibrio, el sistema se ajustará para contrarrestar ese cambio y volver a un nuevo equilibrio.
Por ejemplo:
- Si añades más de un producto a una reacción en equilibrio, el sistema reaccionará para usar ese exceso. La reacción se moverá hacia los reactivos para reducir la cantidad de ese producto.
- Si añades más de un reactivo, la reacción se moverá hacia los productos para usar ese reactivo extra.
Este principio es muy importante en la industria química para controlar las reacciones y obtener la mayor cantidad de productos deseados.
La Energía de Gibbs y el Equilibrio
Un científico llamado J.W. Gibbs sugirió en 1873 que el equilibrio se alcanza cuando la energía de Gibbs de un sistema es la más baja posible. Piensa en la energía de Gibbs como una medida de la energía "útil" disponible en un sistema. Cuando esta energía es mínima, el sistema está en su estado más estable, que es el equilibrio.
La constante de equilibrio (K) está relacionada con la energía de Gibbs. Esta relación nos permite calcular la constante de equilibrio si conocemos los valores de energía de Gibbs de las sustancias.
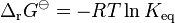
Donde:
- Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \Delta_{\mathrm{r}}G^\ominus es el cambio de la energía de Gibbs en condiciones estándar.
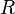 es la constante universal de los gases.
es la constante universal de los gases.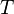 es la temperatura.
es la temperatura.
¿Cómo afectan los cambios a la energía de Gibbs?
Si la energía de Gibbs de un sistema no está en su punto más bajo, la mezcla cambiará su composición hasta que alcance el equilibrio. Es como una pelota rodando cuesta abajo hasta llegar al punto más bajo del valle.
- Si la cantidad de un reactivo aumenta, la reacción se moverá hacia los productos. Esto reduce la energía de Gibbs y lleva al sistema hacia el equilibrio.
- Si la cantidad de un producto aumenta, la reacción se moverá hacia los reactivos. Esto también reduce la energía de Gibbs.
Sustancias Puras en Equilibrio
Cuando hay sustancias puras, como líquidos o sólidos, en una reacción en equilibrio, no las incluimos en la ecuación de la constante de equilibrio. Esto se debe a que su "concentración" o "actividad" se considera constante.
Por ejemplo, en la reacción del ácido acético con agua:

La cantidad de agua es tan grande que su concentración apenas cambia. Por eso, la ecuación de equilibrio se simplifica a:
![K=\rm \frac{[{CH_3CO_2}^-][{H_3O}^+]} {[{CH_3CO_2H}]}](/images/math/4/0/5/405e064eb4d212886d07c5c1232796cd.png)
Lo mismo ocurre con los sólidos. En la reacción Boudouard:
El carbono (C) es un sólido puro, así que no aparece en la ecuación de la constante de equilibrio:
![K_c=\rm \frac{[CO_2]} {[CO]^2}](/images/math/e/7/1/e71a3b44b401bd68038e61bc49ae6caa.png)
Equilibrios Múltiples
Algunas sustancias pueden participar en varias reacciones de equilibrio al mismo tiempo. Por ejemplo, un ácido que puede liberar más de un protón (como el H2A) lo hace en pasos:
1. Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \mathrm{H_2A \rightleftarrows HA^- + H^+} (primera liberación de protón) 2. Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \mathrm{HA^- \rightleftarrows A^{2-} + H^+} (segunda liberación de protón)
Cada paso tiene su propia constante de equilibrio. La constante de equilibrio total para la reacción completa es el producto de las constantes de cada paso.
El Efecto de la Temperatura en el Equilibrio
La temperatura es uno de los factores que sí afectan el valor de la constante de equilibrio. La relación se describe con la ecuación de Van't Hoff.
- Para reacciones que liberan calor (llamadas exotérmicas,
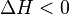 ), si aumentas la temperatura, la constante de equilibrio (K) disminuye. Esto significa que se formarán menos productos.
), si aumentas la temperatura, la constante de equilibrio (K) disminuye. Esto significa que se formarán menos productos. - Para reacciones que necesitan calor (llamadas endotérmicas,
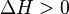 ), si aumentas la temperatura, la constante de equilibrio (K) aumenta. Esto significa que se formarán más productos.
), si aumentas la temperatura, la constante de equilibrio (K) aumenta. Esto significa que se formarán más productos.
Esto es otra aplicación del Principio de Le Châtelier: si añades calor (aumentas la temperatura), el sistema intentará absorber ese calor extra.
Tipos de Equilibrio y Aplicaciones
El equilibrio químico es un concepto fundamental en muchas áreas de la ciencia y la vida diaria:
- En la industria: Es clave para fabricar productos químicos, como el amoníaco en el proceso Haber-Bosch.
- En la naturaleza: Afecta la Química de la atmósfera y la composición del agua de mar.
- En la medicina: Es importante para entender cómo los medicamentos se distribuyen en el cuerpo o cómo la hemoglobina transporta oxígeno en la sangre.
- En el laboratorio: Se usa para entender las reacciones ácido-base, como las que ocurren en las soluciones tampón que mantienen el pH estable.
Composición de una Mezcla en Equilibrio
Calcular la cantidad exacta de cada sustancia en una mezcla en equilibrio puede ser complicado. Hay varios métodos, pero uno común es usar las ecuaciones de balance de masa. Estas ecuaciones se basan en la conservación de la masa: la cantidad total de cada elemento en el sistema debe ser constante.
Por ejemplo, si disuelves un ácido en agua, puedes escribir ecuaciones que relacionen la cantidad total de ácido que pusiste con las diferentes formas en que existe en la solución (ácido sin reaccionar, iones, etc.).
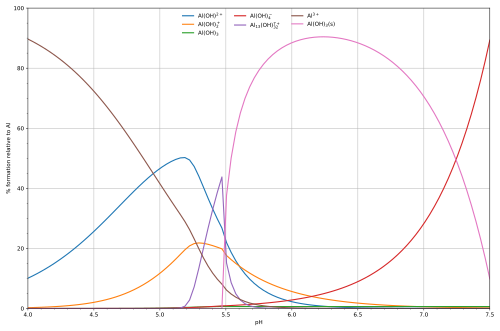
Este tipo de cálculos nos ayuda a entender cómo se comportan las sustancias en diferentes condiciones. Por ejemplo, el diagrama de la hidrólisis del aluminio muestra cómo las diferentes formas de aluminio (iones o precipitados) cambian según el pH de la solución. A cierto pH, el hidróxido de aluminio puede precipitar, lo que significa que se forma un sólido y sale de la solución.
Espontaneidad de las Reacciones
¿Cómo sabemos si una reacción ocurrirá por sí sola (será espontánea) o si necesitamos darle energía para que suceda? Para saberlo, los científicos usan la energía de Gibbs (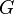 ).
).
La energía de Gibbs considera dos cosas importantes:
- El cambio de entalpía (
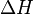 ): si la reacción libera o absorbe calor.
): si la reacción libera o absorbe calor. - El cambio de entropía (
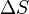 ): si la reacción aumenta o disminuye el desorden.
): si la reacción aumenta o disminuye el desorden.
La fórmula es:
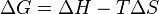
- Si
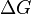 es negativo (< 0), la reacción es espontánea. Ocurrirá por sí sola.
es negativo (< 0), la reacción es espontánea. Ocurrirá por sí sola. - Si
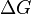 es positivo (> 0), la reacción no es espontánea. Necesita energía para ocurrir.
es positivo (> 0), la reacción no es espontánea. Necesita energía para ocurrir. - Si
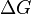 es cero (= 0), el sistema está en equilibrio.
es cero (= 0), el sistema está en equilibrio.
Esto nos ayuda a predecir si una reacción es posible y en qué dirección se moverá.
Véase también
 En inglés: Equilibrium Facts for Kids
En inglés: Equilibrium Facts for Kids
- Constante de equilibrio
- Principio de Le Châtelier
- Ecuación de Henderson-Hasselbalch