Fósforo para niños
Datos para niños Silicio ← Fósforo → Azufre |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
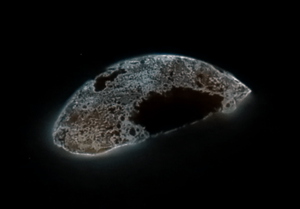
 Polvo de fósforo rojo
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Fósforo, P, 15 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | No metales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 15, 3, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 30,9737620 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Ne] 3s2 3p3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 5 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Existen dos alótropos: fósforo rojo y fósforo blanco. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 100 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 2,19 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 98 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 106 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de van der Waals | 180 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | ±3,+5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óxido | Levemente ácido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 1011,8 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 1907 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª energía de ionización | 2914,1 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª energía de ionización | 4963,6 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5.ª energía de ionización | 6273,9 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido (diamagnético) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 1823 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 317,3 K (44 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 550 K (277 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 12,129 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 0,657 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 20,8 Pa a 294 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Monoclínica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 769 J/(kg·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | 10-9 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 0,235 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del fósforo | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El fósforo es un elemento químico con el número atómico 15 y el símbolo P. Su nombre viene del griego y significa "portador de luz". Es un no metal que forma parte del grupo del nitrógeno en la tabla periódica.
En la naturaleza, el fósforo se encuentra combinado en fosfatos y en los seres vivos. Nunca se encuentra solo. Es un elemento muy reactivo. Cuando entra en contacto con el oxígeno del aire, reacciona y puede emitir luz.
El fósforo es parte de un ciclo natural en la corteza terrestre. Se encuentra en rocas especiales. Cuando estas rocas se desgastan, liberan compuestos de fósforo al suelo y al agua. Las plantas los absorben por sus raíces. Así, el fósforo pasa a los animales que comen esas plantas. Cuando las plantas o los animales mueren, el fósforo vuelve al suelo.
Contenido
Fósforo: Un Elemento Brillante y Esencial
El fósforo es un elemento muy importante para la vida y para muchas cosas que usamos a diario.
¿Qué es el Fósforo?
- Es un componente clave en el medio ambiente.
- Es el segundo mineral más abundante en el cuerpo humano.
- Forma parte del ADN y ARN, que son las instrucciones de la vida.
- También es un componente principal de los huesos y dientes de los animales.
- En los animales, el fósforo puede ser hasta el 1% de su peso.
- En las plantas, es aproximadamente el 0,2% de su peso.
- El fósforo común es un sólido.
- Puede ser blanco (si es puro, es incoloro) o rojo.
- Tiene un olor característico que no es muy agradable.
- Es un no metal.
- Puede emitir luz, un fenómeno llamado quimioluminiscencia.
Formas del Fósforo: Alótropos
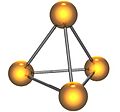
El fósforo puede presentarse de varias maneras, llamadas alótropos. Las más conocidas son el fósforo blanco y el fósforo rojo. Ambos están formados por grupos de cuatro átomos con forma de tetraedro.
Fósforo Blanco: El que Brilla
El fósforo blanco es una forma suave y cerosa. Está hecho de moléculas con cuatro átomos de fósforo (P₄). Es el alótropo menos estable y el más reactivo. También es el que tiene menos densidad y es más volátil.
Cuando el fósforo blanco se expone a la luz o al calor (a 300 °C), se convierte en fósforo rojo. Si se expone al oxígeno, brilla en la oscuridad con un tono verde y azul. Es muy inflamable y puede encenderse solo al contacto con el aire. Por eso, se guarda bajo agua o aceite.
Fósforo Rojo: El de los Fósforos
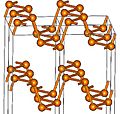
El fósforo rojo tiene una estructura más compleja, como una cadena. Se forma calentando fósforo blanco a 250 °C o exponiéndolo a la luz solar. Es más estable y menos volátil que el fósforo blanco.
Este es el tipo de fósforo que se usa para fabricar las cerillas (fósforos). No se enciende solo en el aire, pero si se calienta, puede transformarse en fósforo blanco y liberar vapores.
Otras Formas del Fósforo
- El fósforo violeta se obtiene calentando fósforo rojo a más de 550 °C.
- El fósforo negro es la forma menos reactiva y la más estable a temperaturas normales. Se parece al grafito, es negro, escamoso y puede conducir la electricidad. Se obtiene calentando fósforo blanco a presiones muy altas.
- El fósforo escarlata se forma cuando una solución de fósforo blanco se evapora bajo la luz del sol.
¿Cómo Brilla el Fósforo?
Cuando el fósforo blanco fue descubierto, se notó que brillaba en la oscuridad. Este brillo se debe a una quimioluminiscencia, que es la emisión de luz por una reacción química sin necesidad de calor.
La reacción ocurre en la superficie del fósforo con el oxígeno del aire. Se forman moléculas que emiten luz visible. El brillo puede durar mucho tiempo porque la reacción es lenta y solo se necesita una pequeña cantidad de estas moléculas.
Aunque el término "fosforescencia" viene del fósforo, el brillo del fósforo es en realidad quimioluminiscencia. La fosforescencia es cuando una sustancia absorbe luz y luego la emite lentamente.
¿Dónde Encontramos el Fósforo?
Fósforo en el Universo
Los científicos han encontrado fósforo en el espacio. En 2013, se detectó en una supernova (una explosión de estrella). Esto confirmó que el fósforo se crea en estas explosiones. En 2020, se encontraron moléculas con fósforo en una zona de formación de estrellas. Se cree que los cometas pudieron traer fósforo a la Tierra primitiva.
Fósforo en la Tierra y en Seres Vivos

El fósforo no se encuentra solo en la naturaleza, sino en muchos minerales, especialmente en forma de fosfatos. La roca fosfórica es la principal fuente de este elemento hoy en día.
Grandes reservas de fósforo se encuentran en países árabes, especialmente en Marruecos. También hay depósitos en China, Rusia y Estados Unidos.
Antiguamente, se obtenía fósforo de fuentes orgánicas como la orina y la ceniza de huesos. La orina, al contener fósforo, se usa todavía en algunos países como Suecia como fertilizante para las plantas.
¿Por Qué es Importante el Fósforo para la Vida?
El fósforo es un elemento químico esencial para los seres vivos.
- Es parte de la molécula de fosfato inorgánico.
- Forma parte del ADN y ARN, que son fundamentales para la herencia y el funcionamiento de las células.
- También está en los fosfolípidos, que son componentes clave de las membranas de las células.
- Las células lo usan para guardar y mover energía a través de una molécula llamada adenosín trifosfato.
- La adición y eliminación de grupos fosfato en las proteínas es un mecanismo principal para controlar cómo funcionan las células.
Historia del Descubrimiento del Fósforo
El nombre "Fósforo" en la antigua Grecia era el nombre del planeta Venus, que significa "portador de luz".
El fósforo fue descubierto por el alquimista alemán Hennig Brand en 1669 en Hamburgo. Él estaba buscando la piedra filosofal y destiló una mezcla de orina y arena. Al evaporar la urea, obtuvo un material blanco que brillaba en la oscuridad y ardía con una llama brillante. Desde entonces, a las sustancias que brillan en la oscuridad sin emitir calor se les llama fosforescentes.
Brand mantuvo su descubrimiento en secreto. Sin embargo, otro alquimista alemán, Johann Kunckel, lo redescubrió en 1677 y le enseñó a Robert Boyle cómo producirlo.
Precauciones con el Fósforo
Algunos compuestos de fósforo son muy importantes para la vida, pero otros pueden ser perjudiciales. Por ejemplo, algunos compuestos se usan para controlar plagas en la agricultura.
El fósforo blanco es peligroso porque se enciende fácilmente en el aire y produce residuos ácidos. Si entra en contacto con la piel, puede causar quemaduras. Por eso, debe guardarse sumergido en aceite o agua para que no toque el oxígeno.
Si alguien entra en contacto con fósforo blanco, es importante lavar la zona afectada. Se puede usar una solución de bicarbonato para neutralizar el ácido que se forma. Las partículas de fósforo blanco a menudo se pueden ver porque emiten humo o brillan en la oscuridad.
El fósforo rojo no se enciende solo en el aire y no es perjudicial en sí mismo. Sin embargo, hay que manejarlo con cuidado. Si se calienta, puede transformarse en fósforo blanco y liberar vapores.
Galería de imágenes
Véase también
 En inglés: Phosphorus Facts for Kids
En inglés: Phosphorus Facts for Kids