Experimento de Rutherford para niños
Los experimentos de Rutherford fueron una serie de descubrimientos importantes que ayudaron a los científicos a entender mejor el átomo. Gracias a ellos, se descubrió que cada átomo tiene un centro muy pequeño y denso llamado núcleo. Este núcleo contiene la mayor parte de la masa del átomo y tiene una carga eléctrica positiva.
Los científicos llegaron a esta conclusión al observar cómo se comportaban unas partículas muy pequeñas, llamadas partículas alfa, cuando chocaban contra una lámina muy fina de metal. Estos experimentos fueron realizados entre 1908 y 1924 por Hans Geiger y Ernest Marsden, bajo la dirección de Ernest Rutherford, en la Universidad de Mánchester.
¿Qué son los Experimentos de Rutherford?
Antes de los experimentos de Rutherford, la idea más aceptada sobre la estructura del átomo era la del científico J.J. Thomson. Thomson había descubierto el electrón, una parte del átomo con carga negativa. Él pensaba que el átomo era como una esfera de carga positiva, con los electrones incrustados en ella, como pasas en un pudín. En ese momento, aún no se conocían los protones (partículas positivas) ni los neutrones (partículas sin carga).
El modelo de Thomson no convencía a todos. El científico japonés Hantaro Nagaoka, por ejemplo, propuso que los electrones giraban alrededor de una carga positiva central, como los anillos de Saturno alrededor del planeta.
El Modelo del Átomo Antes de Rutherford
Según el modelo de Thomson, si una partícula alfa (que tiene carga positiva) chocara con un átomo, debería pasar casi sin desviarse. Esto se debe a que, en el modelo de Thomson, las cargas positivas y negativas del átomo estaban muy extendidas. Por lo tanto, los campos eléctricos del átomo serían muy débiles y no afectarían mucho a una partícula alfa que pasara cerca.
¿Qué se Esperaba Según el Modelo de Thomson?
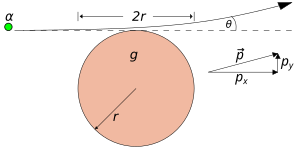
Imagina una partícula alfa pasando muy cerca de un átomo de oro según el modelo de Thomson. Se esperaba que la desviación de la partícula fuera muy, muy pequeña, apenas una fracción de grado. Incluso si la partícula pasara por una lámina de oro de 400 átomos de grosor, la desviación total seguiría siendo mínima.
El Gran Descubrimiento de Rutherford
A petición de Rutherford, sus ayudantes Hans Geiger y Ernest Marsden realizaron una serie de experimentos. Dirigieron un haz de partículas alfa hacia una lámina muy fina de oro y observaron cómo se dispersaban usando una pantalla especial que brillaba al ser golpeada por una partícula.
Lo que descubrieron fue sorprendente: la mayoría de las partículas alfa atravesaban la lámina sin desviarse, como se esperaba. Pero, para su asombro, ¡algunas partículas se desviaban en ángulos muy grandes, e incluso algunas rebotaban hacia atrás! Esto era imposible según el modelo de Thomson.
¿Qué Significaron los Resultados?
El hecho de que algunas partículas rebotaran significaba que habían encontrado una fuerza eléctrica mucho más fuerte de lo que el modelo de Thomson predecía. Esto implicaba que la carga positiva del átomo no estaba extendida, sino concentrada en un volumen muy, muy pequeño.
La mayoría de las partículas pasaron sin desviarse porque el átomo, en su mayor parte, es espacio vacío. Solo una pequeña fracción de partículas chocó con el centro denso y positivo, lo que causó las grandes desviaciones.
Rutherford concluyó que el átomo está formado principalmente por espacio vacío, con casi toda su masa y toda su carga positiva concentradas en un centro diminuto al que llamó núcleo. Alrededor de este núcleo, los electrones se mueven en una gran nube.
En resumen:
- La mayoría de las partículas alfa atravesaron la lámina sin desviarse, lo que indica que el átomo es mayormente espacio vacío.
- Existe una región muy pequeña y densa, el núcleo, que contiene la carga positiva y casi toda la masa del átomo.
- Algunas partículas se desviaron porque pasaron muy cerca del núcleo, que tiene la misma carga positiva que ellas.
- Muy pocas partículas rebotaron porque chocaron directamente con el núcleo.
Cronología de los Experimentos
Los Investigadores Clave
Ernest Rutherford era un profesor de física muy reconocido en la Universidad de Mánchester. Ya había recibido muchos premios por sus estudios sobre la radiación, habiendo descubierto los rayos alfa, beta y gamma, y demostrando que eran el resultado de la desintegración de los átomos. En 1906, conoció a Hans Geiger, un físico alemán, y quedó tan impresionado que le pidió que se quedara y le ayudara en sus investigaciones. Ernest Marsden era un estudiante de física que trabajaba con Geiger.
Las partículas alfa son pequeñas partículas con carga positiva que son emitidas por ciertas sustancias, como el uranio y el radio. Rutherford las había descubierto en 1899. Para sus experimentos, Rutherford y Geiger diseñaron un aparato para contar estas partículas, que fue una versión temprana del contador Geiger.
Los experimentos consistían en bombardear una lámina de metal con partículas alfa para ver cómo se dispersaban. Usaban una pantalla que brillaba (fluorescente) para detectar las partículas. Geiger pasaba horas en un laboratorio oscuro contando los pequeños destellos de luz con un microscopio. Para las láminas, usaban oro porque es muy maleable y se podía hacer muy, muy fina. Como fuente de partículas alfa, usaban radio, que es mucho más radiactivo que el uranio.
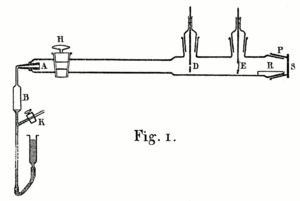
El Experimento de 1908
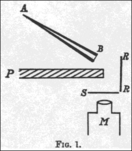
En 1908, Hans Geiger describió un experimento en el que usó un tubo de vidrio largo. En un extremo había una fuente de partículas alfa y en el otro, una pantalla que brillaba. Las partículas alfa pasaban por una pequeña abertura y creaban un punto brillante en la pantalla. Cuando Geiger dejó entrar un poco de aire o colocó una lámina de oro en el camino de las partículas, el punto brillante se extendía. Esto demostró que tanto el aire como la materia sólida podían desviar las partículas alfa, pero este aparato solo podía observar desviaciones pequeñas. Rutherford quería saber si las desviaciones podían ser mucho mayores, incluso de más de 90 grados.
El Experimento de 1909
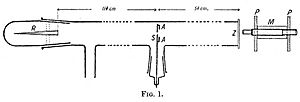
En 1909, Geiger y Marsden demostraron que las partículas alfa podían desviarse más de 90 grados. Colocaron una fuente de partículas alfa de tal manera que las partículas no podían llegar directamente a la pantalla. Notaron algunos destellos en la pantalla, lo que significaba que algunas partículas rebotaban en las moléculas de aire. Luego, colocaron una lámina de metal y vieron muchos más destellos. Contaron los destellos y notaron que los metales más pesados, como el oro, reflejaban más partículas alfa que los más ligeros, como el aluminio.
Más tarde, estimaron que solo una pequeña parte de las partículas alfa que chocaban con el reflector rebotaban hacia la pantalla (aproximadamente 1 de cada 8000).
El Experimento de 1910
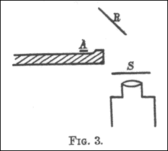
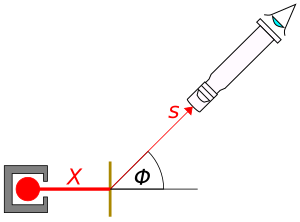
En 1910, Geiger describió un experimento para medir cómo el ángulo de desviación de las partículas alfa cambiaba según el material, su grosor y la velocidad de las partículas. Construyó un tubo de vidrio sin aire. Las partículas alfa pasaban por un pequeño agujero y chocaban con una lámina de metal. Un microscopio permitía medir con precisión dónde aparecían los destellos en la pantalla.
Geiger llegó a las siguientes conclusiones:
- El ángulo de desviación más común aumentaba con el grosor del material.
- El ángulo de desviación más común era proporcional al peso atómico de la sustancia.
- El ángulo de desviación más común disminuía con la velocidad de las partículas alfa.
- La probabilidad de que una partícula se desviara más de 90 grados era muy pequeña.
Rutherford Explica la Dispersión
En 1911, Rutherford publicó un trabajo muy importante donde propuso que el átomo tiene un centro muy pequeño y denso con carga eléctrica. Para sus cálculos, asumió que esta carga central era positiva, aunque en ese momento no podía probarlo.
Rutherford desarrolló una ecuación matemática que explicaba cómo la lámina dispersaría las partículas alfa si toda la carga positiva y la mayor parte de la masa del átomo estuvieran concentradas en un solo punto en el centro.
La Confirmación con la Lámina de Oro
En 1913, Geiger y Marsden realizaron más experimentos para verificar la ecuación de Rutherford. La ecuación predecía que el número de destellos observados en un cierto ángulo debería depender de varias cosas:
- De un factor relacionado con el ángulo de desviación.
- Del grosor de la lámina.
- De la cantidad de carga positiva en el centro del átomo.
- De la masa y velocidad de las partículas alfa.
En su artículo de 1913, describieron cuatro experimentos que demostraron cada una de estas relaciones.
Para probar cómo la dispersión variaba con el ángulo, Geiger y Marsden construyeron un aparato que les permitía mover un microscopio alrededor de la lámina de metal. Así podían contar las partículas alfa desviadas hasta 150 grados. Confirmaron que el número de partículas desviadas en un ángulo dado era proporcional a lo que la ecuación de Rutherford predecía.
También probaron cómo la dispersión variaba con el grosor de la lámina. Usaron un disco con agujeros cubiertos con láminas de metal de diferentes grosores. Observaron que el número de destellos era proporcional al grosor, siempre que la lámina fuera delgada.
Reutilizaron el mismo aparato para ver cómo la dispersión variaba con la carga del núcleo. Asumieron que la carga del núcleo era proporcional al peso atómico del elemento. Probaron con láminas de oro, estaño, plata, cobre y aluminio. Sus resultados confirmaron que la dispersión era proporcional al cuadrado de la carga del núcleo.
Finalmente, probaron cómo la dispersión variaba con la velocidad de las partículas alfa. Ralentizaron las partículas alfa colocando láminas adicionales de mica. Observaron que el número de destellos era proporcional a la inversa de la velocidad elevada a la cuarta potencia, lo que también coincidía con la ecuación de Rutherford.
Rutherford Confirma la Carga Positiva del Núcleo
En su trabajo de 1911, Rutherford había asumido que la carga central del átomo era positiva, pero no estaba completamente seguro. Sin embargo, los resultados de otros experimentos confirmaron su idea. En 1913, Rutherford afirmó que el "núcleo" estaba cargado positivamente, basándose en experimentos que estudiaban la dispersión de partículas alfa en diferentes gases.
En 1917, Rutherford y su asistente William Kay investigaron el paso de partículas alfa a través de gases como el hidrógeno y el nitrógeno. Descubrieron que las partículas alfa podían golpear y expulsar los núcleos de hidrógeno (protones) de los núcleos de nitrógeno. Esto fue una prueba más de que el núcleo tenía una carga positiva.
Véase también
- Dispersión de Rutherford
- Modelo atómico de Thomson
- Joseph Thomson
- Ernest Rutherford
- Modelo atómico de Rutherford
- Partícula Alfa