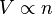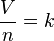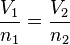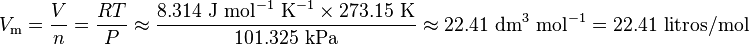Ley de Avogadro para niños
La ley de Avogadro, también conocida como hipótesis de Avogadro o principio de Avogadro, es una regla importante en la química que nos ayuda a entender cómo se comportan los gases. Esta ley relaciona el volumen de un gas con la cantidad de sustancia que tiene. Es una parte especial de una ley más grande llamada la ley de los gases ideales.
En pocas palabras, la ley de Avogadro dice que: "Si tienes volúmenes iguales de diferentes gases, y todos están a la misma temperatura y presión, entonces tendrán el mismo número de moléculas." Esto significa que, para una cantidad específica de un gas ideal, su volumen y la cantidad de gas (medida en moles) están directamente relacionados. Si uno aumenta, el otro también lo hace, siempre y cuando la temperatura y la presión no cambien.
Esta ley fue propuesta por el científico italiano Amedeo Avogadro en 1812. Él pensó que si tomabas dos muestras de un gas ideal con el mismo volumen, temperatura y presión, ambas tendrían la misma cantidad de moléculas. Por ejemplo, si tienes un globo lleno de hidrógeno y otro del mismo tamaño lleno de nitrógeno, y ambos están en las mismas condiciones, ¡tendrán el mismo número de partículas! En la vida real, los gases pueden desviarse un poco de este comportamiento "ideal", pero la ley de Avogadro sigue siendo muy útil para los científicos.
Contenido
¿Cómo se expresa la ley de Avogadro?
La ley de Avogadro se puede escribir de forma matemática para entenderla mejor:
O también así:
Aquí, cada letra tiene un significado:
- V es el volumen del gas (cuánto espacio ocupa).
- n es la cantidad de sustancia del gas (cuántas partículas hay, medida en moles).
- k es una constante, un número que no cambia si la temperatura y la presión son fijas.
Esta fórmula nos dice que si la temperatura y la presión son las mismas, volúmenes iguales de cualquier gas tienen el mismo número de moléculas. Si queremos comparar la misma sustancia en dos situaciones diferentes, podemos usar esta otra forma:
Esta ecuación nos muestra que si la cantidad de gas (n) aumenta, el volumen (V) también lo hace de forma proporcional. Y si la cantidad de gas disminuye, el volumen también se hace más pequeño. Esto es muy interesante porque significa que el número de moléculas en un volumen específico de gas no depende de lo grandes que sean esas moléculas o de su peso.
¿De dónde viene la ley de Avogadro?
La ley de Avogadro se puede entender a partir de una ley más general llamada la ley de los gases ideales. Esta ley se expresa como:
Donde:
- P es la presión del gas.
- V es el volumen del gas.
- n es la cantidad de sustancia (moles).
- R es la constante de los gases (un número fijo).
- T es la temperatura en Kelvin.
Si reorganizamos esta ecuación, podemos ver la ley de Avogadro:
- Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \frac{V}{n} = \frac{RT}{P}
Como R, T y P son constantes en ciertas condiciones, la relación V/n también es una constante, que es nuestra k de la ley de Avogadro.
Historia de la ley de Avogadro
La hipótesis de Avogadro (como se le llamó al principio) fue propuesta en 1811. En ese tiempo, ya existían otras leyes sobre los gases, como la ley de Boyle y la ley de Charles. La idea de Avogadro fue muy importante porque ayudó a unir la teoría atómica de Dalton con las observaciones de Joseph Louis Gay-Lussac. Gay-Lussac había notado que los gases se combinaban en proporciones simples de volumen. Avogadro explicó que esto sucedía porque volúmenes iguales de gases tenían el mismo número de partículas.
En 1814, otro científico, André-Marie Ampère, llegó a la misma conclusión que Avogadro de forma independiente. Por eso, a veces a esta ley se le llama también la hipótesis de Avogadro-Ampère.
Al principio, algunos experimentos con ciertas sustancias inorgánicas parecían contradecir la ley de Avogadro. Pero años después, en 1860, el químico Stanislao Cannizzaro explicó que estas "excepciones" se debían a que algunas moléculas se separaban a ciertas temperaturas. Cannizzaro demostró que la ley de Avogadro era correcta y que servía para determinar no solo el peso de las moléculas, sino también el de los átomos.
La ley de los gases ideales
Las leyes de Boyle, Charles y Gay-Lussac, junto con la ley de Avogadro, fueron combinadas por Émile Clapeyron en 1834 para crear la ley de los gases ideales. Esta ley es una forma muy útil de describir cómo se comportan los gases en muchas situaciones. Más tarde, otros científicos desarrollaron la teoría cinética de los gases, que explica la ley de los gases ideales basándose en cómo se mueven los átomos y moléculas en un gas.
La constante de Avogadro
Gracias a la ley de Avogadro, los científicos pudieron calcular cuántas partículas hay en una cantidad específica de gas. En 1865, Johann Josef Loschmidt usó esta idea para estimar por primera vez el tamaño de una molécula. Esto llevó al concepto de la constante de Loschmidt.
Más tarde, experimentos como el de la gota de aceite de Robert Andrews Millikan ayudaron a determinar la carga de un electrón. Usando esto junto con la constante de Faraday, se pudo calcular el número de partículas en un mol de sustancia. Jean Perrin nombró a este número la constante de Avogadro en honor a Amedeo Avogadro por su importante descubrimiento. Hoy en día, esta constante es fundamental en el Sistema Internacional de Unidades.
Volumen molar
El volumen molar es el volumen que ocupa un mol de cualquier gas ideal bajo ciertas condiciones de temperatura y presión.
Si tomamos las condiciones estándar de temperatura y presión (STP), que son 101.325 kilopascales (presión) y 273.15 K (temperatura), podemos calcular el volumen de un mol de gas:
Esto significa que, en condiciones estándar, un mol de cualquier gas ideal ocupa aproximadamente 22.41 litros. ¡Es como el volumen de una pelota de baloncesto grande!
Galería de imágenes
Véase también
 En inglés: Avogadro's law Facts for Kids
En inglés: Avogadro's law Facts for Kids
- Ley de Boyle
- Ley de Charles
- Ley de Gay-Lussac
- Gas ideal
Referencias