Estaño para niños
Datos para niños Indio ← Estaño → Antimonio |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Estaño, Sn, 50 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Metales del bloque p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 14, 5, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 118,710 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Kr] 4d10 5s2 5p2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Mohs | 1,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 18, 4 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
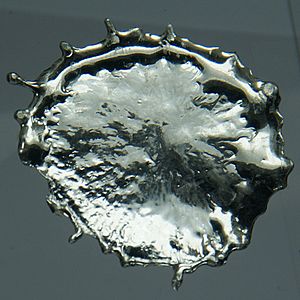
| Apariencia | Gris plateado brillante | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 145 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,96 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 145 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 180 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de van der Waals | 217 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 4,2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óxido | Anfótero | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 708,6 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 1411,8 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª energía de ionización | 2943,0 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª energía de ionización | 3930,3 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5.ª energía de ionización | 7456 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 7365 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 505,08 K (232 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 2875 K (2602 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 295,8 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 7,029 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 5,78·10-21 Pa a 505 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Tetragonal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 228 J/(kg·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | 9,17·106 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 66,6 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 2500 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del estaño | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El estaño es un elemento químico con el símbolo Sn. Su número atómico es 50. Lo puedes encontrar en el grupo 14 de la tabla periódica de los elementos. El estaño tiene 10 isótopos estables, que son formas diferentes del mismo elemento. Su mineral principal se llama casiterita.
Contenido
Estaño: Un Metal Versátil
El estaño es un elemento químico que se encuentra en estado sólido a temperatura ambiente (20 °C). Es un metal que se puede moldear fácilmente (es maleable). También es resistente a la corrosión porque forma una capa protectora en su superficie.
Cuando doblas una barra de estaño, puedes escuchar un sonido especial. A esto se le llama el grito del estaño. Esto ocurre por la forma en que sus cristales se frotan entre sí.
El estaño puro puede presentarse de dos formas:
- El estaño gris: Es un polvo no metálico, frágil y estable a temperaturas por debajo de 13,2 °C.
- El estaño blanco: Es la forma metálica normal, brillante y estable a temperaturas por encima de 13,2 °C.
Propiedades del Estaño
El estaño tiene características únicas que lo hacen muy útil.
Propiedades Físicas
El estaño es un metal de color blanco plateado. Es muy maleable (se puede estirar y moldear) y dúctil (se puede convertir en hilos). Se derrite a una temperatura relativamente baja, alrededor de 232 °C.
A temperaturas frías, el estaño blanco puede transformarse en estaño gris. Este cambio se conoce como la «plaga del estaño». Sin embargo, si el estaño tiene pequeñas cantidades de otras sustancias, como bismuto o antimonio, esta transformación es menos probable que ocurra. Esto hace que el estaño sea más duradero.
El estaño también puede volverse un superconductor si se enfría mucho, por debajo de -269,43 °C (3,72 K). Fue uno de los primeros materiales en los que se descubrió el efecto Meissner, una propiedad especial de los superconductores.
Propiedades Químicas
El estaño es bueno para resistir la corrosión. Sin embargo, algunos ácidos y álcalis pueden dañarlo. Se puede pulir mucho y se usa para cubrir otros metales y protegerlos. La capa de óxido que se forma en su superficie lo protege de oxidarse más.
Isótopos del Estaño
Anexo:Isótopos de estaño El estaño es especial porque tiene diez isótopos estables. Esto es más que cualquier otro elemento. Los isótopos son versiones del mismo elemento con diferente número de neutrones. Los más comunes son el 120Sn, 118Sn y 116Sn.
Los científicos creen que el gran número de isótopos estables del estaño se debe a que su número atómico (50) es un "número mágico" en la física nuclear. Esto significa que su núcleo es especialmente estable.
Usos del Estaño en la Vida Diaria
El estaño se utiliza en muchas cosas que vemos a diario:
- Protege el hierro y el acero en las latas de alimentos.
- Ayuda a que el vidrio sea menos frágil.
- Sus compuestos se usan en productos como fungicidas, tintes y dentífricos.
- Es un ingrediente clave en el bronce, una aleación de estaño y cobre.
- Se usa en la soldadura blanda, a menudo mezclado con plomo.
- Se utiliza en los tubos de los órganos musicales.
- Sirve para hacer etiquetas.
- Es importante en la industria de la cerámica para crear esmaltes.
- Se usa para sellar botellas de vino con cápsulas.
Historia del Estaño
El estaño se empezó a usar hace mucho tiempo, alrededor del año 4000 a.C., en lugares como el Cercano Oriente y los Balcanes. Se mezclaba con cobre para crear el bronce. Esta nueva aleación fue muy importante y dio nombre a la «Edad del Bronce».
El bronce era muy valioso porque permitía fabricar armas y herramientas más fuertes. Esto llevó a un gran comercio de estaño en la antigüedad. Al principio, el estaño se encontraba en el mineral casiterita, que es fácil de reconocer por su color oscuro y porque se acumula en los ríos.
¿Cómo se Obtiene el Estaño?
El estaño se obtiene principalmente del mineral llamado casiterita. Este mineral contiene óxido de estaño. Para extraer el estaño, la casiterita se muele y se procesa para aumentar la cantidad de óxido de estaño. Luego, se calienta con coque (un tipo de carbón) en un horno especial para obtener el metal puro.
Aleaciones de Estaño
Las aleaciones son mezclas de metales. Las aleaciones de estaño, también llamadas metales blancos, suelen contener cobre, antimonio y plomo. Estas mezclas tienen diferentes propiedades, dependiendo de cuánto de cada metal se use.
Algunas aleaciones de estaño se usan en cojinetes (partes de máquinas que reducen la fricción). Las aleaciones de estaño y plomo son muy comunes en la soldadura blanda, especialmente para componentes electrónicos. Sin embargo, debido a preocupaciones sobre el plomo, se están desarrollando nuevas aleaciones sin plomo, como las de estaño-plata-cobre.
El peltre es otra aleación famosa que contiene estaño, plomo y antimonio. Se usa para hacer objetos decorativos. El estaño también se encuentra en aleaciones para prótesis dentales y en aleaciones de titanio y circonio.
Producción Mundial de Estaño
Los países que más estaño producen en el mundo son China, Malasia, Perú, Indonesia, Bolivia y Brasil.
|
||||||||||||||||||||||
| Fuente: United States Geological Survey (USGS) - 2021 |
El estaño es parte de un grupo de minerales importantes para la industria. A veces, estos minerales se extraen en zonas donde hay conflictos. Por eso, existen reglas para asegurar que su comercio no apoye situaciones difíciles.
El Estaño y el Medio Ambiente
El estaño y sus compuestos pueden llegar al medio ambiente de forma natural o por actividades humanas. Esto incluye la minería y la industria.
Cuando el estaño metálico se libera al aire, se pega a las partículas de polvo. Estas partículas pueden viajar con el viento o la lluvia. Si el estaño se combina con otras sustancias, forma compuestos que pueden quedarse en el suelo o disolverse en el agua.
Algunos compuestos de estaño, especialmente los que contienen carbono, pueden acumularse en el suelo o el agua. También pueden ser absorbidos por los seres vivos.
¿Cómo Afecta el Estaño a las Personas?
Las personas pueden entrar en contacto con el estaño de varias maneras:
- Al comer o beber de latas que contienen estaño, aunque muchas latas modernas tienen una capa protectora.
- Al consumir pescado o mariscos de aguas con estaño.
- Al tocar productos que contienen estaño, como algunos plásticos.
- Al respirar aire con vapores o polvo de estaño.
El estaño metálico no es muy perjudicial si se ingiere, ya que el cuerpo no lo absorbe bien. Sin embargo, respirar sus vapores puede afectar el sistema respiratorio.
Si se ingieren grandes cantidades de ciertos compuestos de estaño, pueden causar malestar estomacal o afectar el hígado y los riñones. Algunos compuestos de estaño pueden influir en el sistema nervioso. Otros pueden afectar el sistema de defensas del cuerpo en animales. El contacto con la piel o los ojos puede causar irritación.
Límites de Seguridad
Existen límites de seguridad para la cantidad de estaño inorgánico en los alimentos. Estos límites ayudan a proteger nuestra salud. Por ejemplo, en la Unión Europea, los alimentos enlatados (excepto bebidas) no deben tener más de 200 miligramos de estaño por kilogramo.
| Estaño inorgánico | Contenidos máximos (mg/kg peso fresco) |
|---|---|
| Alimentos enlatados diferentes de las bebidas | 200 |
| Bebidas enlatadas incluidos zumos de frutas y verduras | 100 |
| Alimentos infantiles enlatados y alimentos enlatados elaborados a base de cereales para lactantes y niños de corta edad, excepto productos deshidratados y en polvo | 50 |
| Preparados para lactantes y preparados de continuación enlatados (incluida la leche para lactantes y la leche de continuación), excepto productos deshidratados y en polvo | 50 |
| Alimentos dietéticos enlatados destinados a usos médicos especiales, específicamente destinados a los lactantes, excepto productos deshidratados y en polvo | 50 |
Galería de imágenes
Véase también
 En inglés: Tin Facts for Kids
En inglés: Tin Facts for Kids