Espectroscopia para niños
La espectroscopia es una rama de la ciencia que estudia cómo la radiación electromagnética (como la luz) interactúa con la materia. Imagina que la luz es como un mensaje secreto que nos cuenta de qué están hechas las cosas y cómo se comportan. La espectroscopia nos ayuda a descifrar ese mensaje.
Esta técnica se usa en muchos campos, como la astronomía (para estudiar estrellas y planetas), la física, la química y la biología.
El análisis espectral se basa en detectar cómo la materia absorbe o emite luz en diferentes colores o "longitudes de onda". Cada color de luz tiene una energía específica, y cuando esa energía coincide con los niveles de energía de los átomos o moléculas, ocurre una interacción.
Hay diferentes formas en que la luz puede interactuar con la materia:
- Cuando los fotones (pequeñas partículas de luz) chocan y solo cambian su dirección, como ocurre con los rayos X.
- Cuando la luz choca y pierde algo de energía, como en la espectroscopia Raman.
- Cuando la materia absorbe o emite luz de forma específica, como si fuera un eco.
Contenido
¿Qué es la Espectroscopia?
La idea principal de la espectroscopia es que la luz está hecha de diferentes "colores" o longitudes de onda, y cada una tiene una frecuencia distinta. Lo más importante es que cada elemento químico de la tabla periódica tiene una "firma" de luz única. Es como una huella digital que solo ese elemento puede emitir o absorber.
Esta huella aparece siempre en la misma parte del espectro electromagnético cuando la luz se separa. Esto abrió un campo de estudio enorme, ya que todo lo que nos rodea está hecho de átomos. La espectroscopia es clave para entender las propiedades de la materia a nivel atómico.
¿Cómo funciona la Espectroscopia?
La espectroscopia nos permite saber a qué frecuencia o longitud de onda una sustancia puede absorber o emitir energía en forma de luz. La energía de un fotón (una "partícula" de luz) está relacionada con la diferencia de energía entre dos estados de la sustancia que se estudia.
Esto se describe con una ecuación básica:
Donde 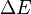 es la diferencia de energía,
es la diferencia de energía, 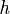 es la constante de Planck (un número muy pequeño pero importante), y
es la constante de Planck (un número muy pequeño pero importante), y 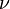 es la frecuencia de la luz.
es la frecuencia de la luz.
Las diferencias de energía entre los estados de los átomos o moléculas dependen de su composición. Por eso, este método da información valiosa a científicos de muchas áreas. Un aparato llamado espectrofotómetro mide el espectro de la luz, es decir, cuánta luz se absorbe, refleja o emite en función de su frecuencia o longitud de onda. Los espectros son muy diferentes para cada elemento.
La "huella digital" de la luz
En general, un "espectro" es la forma en que la intensidad de la luz se distribuye según su frecuencia o longitud de onda. Además de la luz visible (la que podemos ver), la espectroscopia estudia una gran parte del espectro electromagnético, incluyendo ondas de radio, microondas, infrarrojo, ultravioleta y rayos X.
El objetivo principal de la espectroscopia es obtener información sobre una muestra o un objeto que emite luz. Por ejemplo, puede decirnos:
- La estructura interna o la temperatura de estrellas.
- La composición o cómo ocurre una reacción química.
- Identificar átomos o moléculas por sus espectros únicos.
Un poco de historia: ¿Quién la descubrió?
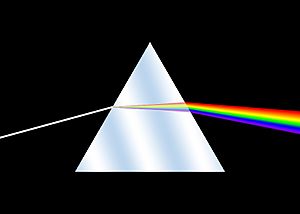
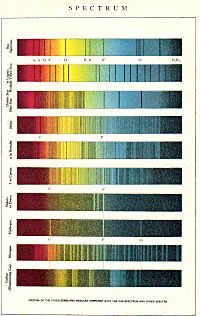
La historia de la espectroscopia comenzó con los experimentos de óptica de Isaac Newton (1666-1672). Desde la antigüedad, los filósofos naturales habían especulado sobre la naturaleza de la luz y su comprensión moderna comenzó con el experimento del prisma: «En 1672, en el primer artículo que envió a la Royal Society, Isaac Newton describió un experimento en el que permitió que la luz del sol pasara a través de un pequeño orificio y luego a través de un prisma, Newton descubrió que la luz del sol, que nos parece blanca, en realidad está formado por una mezcla de todos los colores del arcoíris». Newton aplicó la palabra «espectro» (spectrum) para describir el arcoíris de colores que se combinan para formar la luz blanca y que se revelan cuando cualquier haz incidente de luz blanca, no necesariamente procedente del Sol, pasa a través de un prisma. Newton tuvo que esforzarse para demostrar que los colores no eran introducidos por el prisma, sino que realmente eran los constituyentes de la luz blanca.
En los siglos XVIII y XIX, el prisma usado para descomponer la luz fue mejorado con rendijas y lentes telescópicas con lo que se consiguió así una herramienta más potente y precisa para examinar la luz procedente de distintas fuentes. «En 1802, William Hyde Wollaston construyó un espectrómetro mejorado que incluía una lente para enfocar el espectro del Sol sobre una pantalla. Al usarlo, Wollaston se dio cuenta de que los colores no se distribuían uniformemente, sino que faltaban parches de colores, que aparecían como bandas oscuras en el espectro». Joseph von Fraunhofer, astrónomo y físico, utilizó ese espectroscopio dispersivo inicial para descubrir en 1815 que el espectro de la luz solar estaba dividido por una serie de líneas oscuras —hoy líneas de Fraunhofer—, cuyas longitudes de onda calculó con extremo cuidado.
Sin embargo, la luz generada en laboratorio mediante el calentamiento de gases, metales y sales mostraba una serie de líneas estrechas, coloreadas y brillantes sobre un fondo oscuro. La longitud de onda de cada una de esas bandas era característica del elemento que se había calentado y fue cuando surgió la idea de utilizar esos espectros como huella digital de los elementos. A partir de ese momento, se desarrolló una verdadera industria dedicada exclusivamente a la realización de espectros de todos los elementos y compuestos conocidos: la espectroscopia se convirtió en una técnica científica más precisa y cuantitativa que desempeñó, y sigue desempeñando, un papel importante en la química, la física y la astronomía.
También se descubrió que, si se calentaba un elemento lo suficientemente (incandescente), producía una luz blanca continua, con un espectro completo de todos los colores, sin ningún tipo de línea o banda oscura. En poco tiempo se avanzó al hacer pasar esa luz de espectro continuo a través de una fina película a una temperatura menor de un elemento seleccionado. En 1860, el físico Gustav Kirchhoff y el químico Robert Bunsen, tras un laborioso trabajo para obtener muestras puras de los elementos conocidos, ya habían mostrado que las líneas oscuras en el espectro solar correspondían con las líneas brillantes en los espectros de algunos gases conocidos, siendo líneas específicas que correspondían a elementos químicos únicos presentes en la atmósfera del Sol: cada elemento emitía y absorbía luz a ciertas frecuencias fijas que lo caracterizaban. Kirchhoff dedujo que las líneas oscuras en el espectro solar eran causadas por la absorción de elementos químicos en la atmósfera solar. De esta manera se comprobó que los elementos químicos que se encuentran en el Sol y en las estrellas también se encontraban en la Tierra y fue la prueba de que la materia de los objetos celestes era la misma que la de la Tierra. Este descubrimiento también condujo a un nuevo método de análisis indirecto, que permitía conocer la constitución química de las estrellas lejanas y clasificarlas.
Kirchhoff y Bunsen estudiaron el espectro del Sol en 1861, identificando los elementos químicos de la atmósfera solar y descubriendo dos nuevos elementos en el transcurso de sus investigaciones, el cesio y el rubidio. Norman Lockyer también estudió los espectros solares y estelares y en 1868 detectó líneas radiantes y oscuras en los espectros solares. Trabajando con el químico Edward Frankland para investigar los espectros de los elementos a varias temperaturas y presiones, no pudo asociar una línea amarilla del espectro solar con ningún elemento conocido, afirmando que la línea representaba un nuevo elemento, que llamó helio, en honor al griego Helios, la personificación del sol. En 1895 se descubrió el helio terrestre.
La historia de la espectroscopia empezó con los experimentos de Isaac Newton entre 1666 y 1672.
Isaac Newton y el arcoíris
Newton hizo un famoso experimento: dejó que la luz del sol pasara por un pequeño agujero y luego por un prisma. Descubrió que la luz blanca del sol, que parece de un solo color, en realidad está formada por una mezcla de todos los colores del arcoíris. Newton usó la palabra "espectro" para describir este arcoíris de colores. Demostró que los colores no los creaba el prisma, sino que ya estaban en la luz blanca.
Fraunhofer y las líneas oscuras
En los siglos XVIII y XIX, los prismas mejoraron. En 1802, William Hyde Wollaston notó que los colores del espectro del sol no estaban distribuidos de manera uniforme; faltaban algunos, apareciendo como bandas oscuras. En 1815, el astrónomo Joseph von Fraunhofer usó un espectroscopio para descubrir que el espectro de la luz solar tenía una serie de líneas oscuras, que hoy se llaman líneas de Fraunhofer. Calculó sus longitudes de onda con mucha precisión.
Por otro lado, la luz producida al calentar gases o metales en el laboratorio mostraba líneas brillantes y coloreadas sobre un fondo oscuro. Cada una de estas líneas era única para el elemento que se había calentado. Así surgió la idea de usar estos espectros como "huellas digitales" de los elementos.
Kirchhoff y Bunsen: Elementos en el Sol
En 1860, el físico Gustav Kirchhoff y el químico Robert Bunsen demostraron que las líneas oscuras en el espectro del sol coincidían con las líneas brillantes de algunos gases conocidos. Esto significaba que cada elemento emitía y absorbía luz a frecuencias fijas que lo caracterizaban. Kirchhoff concluyó que las líneas oscuras en el espectro solar eran causadas por la absorción de elementos químicos en la atmósfera del Sol.
Esto probó que los elementos químicos en el Sol y las estrellas son los mismos que encontramos en la Tierra. Este descubrimiento permitió conocer la composición química de estrellas lejanas. Kirchhoff y Bunsen incluso descubrieron dos nuevos elementos, el cesio y el rubidio, al estudiar el espectro del Sol. Más tarde, en 1868, Norman Lockyer detectó una línea amarilla en el espectro solar que no correspondía a ningún elemento conocido en la Tierra. La llamó helio, en honor al sol (Helios en griego). El helio terrestre fue descubierto en 1895.
¿Para qué sirve la Espectroscopia?
Los astros, como las estrellas y los planetas, y también la materia interestelar, emiten ondas electromagnéticas. Los astrónomos han aprendido mucho sobre el espacio exterior descifrando los mensajes que estas ondas traen a nuestro planeta. La forma en que estas ondas se emiten y cambian depende de muchos factores: la composición del objeto, su temperatura, presión, si está ionizado, y la influencia de campos magnéticos y eléctricos.
Los científicos pueden recrear estas condiciones en laboratorios y obtener espectros de referencia. Estos espectros sirven como patrones para analizar la luz de los cuerpos celestes y extraer toda la información que contienen.
Estudiando las estrellas y el universo
Las "huellas digitales" de los átomos de un elemento químico son tan únicas como las de una persona. Los físicos han catalogado todas las radiaciones luminosas que emite cada elemento cuando está muy caliente (incandescente).
Cuando la luz de una estrella llega a la Tierra, es una mezcla de radiaciones de átomos de hidrógeno, helio, hierro, etc. Si esa luz pasa por un prisma, los diferentes colores se separan. El prisma desvía la luz roja (longitud de onda más larga) hacia un lado y la luz violeta (longitud de onda más corta) hacia el otro. Entre ellos se ordenan los demás colores: anaranjado, amarillo, verde, azul y añil. Así se obtiene un "espectro continuo", que parece una franja de arcoíris.
Pero hay algo más. Cuando la luz de la estrella viaja, si encuentra un vapor con átomos del mismo elemento en la atmósfera de la estrella, esa luz es absorbida. Por eso, en el espectro que recibimos en la Tierra, aparecerán rayas oscuras donde la luz fue absorbida. En lugar de un "espectro de emisión" (solo colores), obtenemos un "espectro de absorción" (colores con rayas oscuras), que nos muestra qué elementos químicos hay en la estrella.
Midiendo la temperatura y el movimiento
Además de la composición, el espectro también nos dice si un objeto luminoso se acerca o se aleja de la Tierra, y a qué velocidad relativa lo hace. Esto se conoce como el efecto Doppler-Fizeau.
En el espectro de las estrellas, siempre hay una zona de radiaciones más intensas. Esta zona nos indica la temperatura de la superficie de la estrella. Sabemos que un metal caliente empieza a brillar en rojo oscuro, luego se vuelve más claro y finalmente blanco. De la misma manera, las estrellas rojas son menos calientes que las anaranjadas, y estas menos que las amarillas, y así sucesivamente. Gracias a los espectros, los astrónomos han podido calcular la temperatura de las estrellas y clasificarlas.
Al comparar las rayas del espectro de una estrella con las de una luz terrestre, a veces se observa que las rayas estelares están ligeramente "corridas" hacia el extremo rojo o hacia el violeta del espectro. Este fenómeno, debido al efecto Doppler-Fizeau, permite calcular la velocidad radial con la que la estrella se aleja o se acerca a la Tierra. Gracias a esto, se descubrió que todas las galaxias se alejan unas de otras, lo que es una prueba de la expansión del universo.
Descubriendo nuevos elementos
Finalmente, el análisis espectral permitió descubrir el helio en 1868, después de un eclipse solar. Desde entonces, el análisis espectral de los cuerpos celestes ha revelado que todos están compuestos por los mismos elementos que conocemos en la Tierra, los que aparecen en la tabla periódica.
Tipos de Espectroscopia
Los principales fenómenos que se usan en espectroscopia son:
- La emisión de luz por una muestra después de ser excitada (por luz, calor o electricidad): espectroscopia de emisión.
- La absorción de luz por una muestra cuando es iluminada: espectroscopia de absorción.
- La fluorescencia (cuando una sustancia absorbe luz y luego emite otra luz): espectroscopia de fluorescencia.
Estos fenómenos pueden estudiar:
- Las propiedades de las moléculas, que tienen que ver con los electrones en los enlaces químicos: espectroscopia molecular.
- Las propiedades de los átomos, que tienen que ver con los electrones de los átomos: espectroscopia atómica.
Aquí tienes una tabla con algunas técnicas de espectroscopia según el tipo de onda electromagnética que usan:
| Dominio de longitud de onda | Longitud de onda | Tipo de espectroscopia | Comentarios |
| Radiofrecuencia | > 100 µm | Espectroscopia de resonancia magnética nuclear | Estudia enlaces químicos, forma de moléculas y distancias entre átomos. |
| Resonancia paramagnética electrónica | Estudia sustancias con propiedades magnéticas. | ||
| Resonancia ferromagnética | Estudia la magnetización de materiales magnéticos. | ||
| Microondas | > 30 µm | Espectroscopia rotacional | Estudia la estructura de moléculas pequeñas (como agua o ozono) con mucha precisión. |
| Infrarrojo | 1-20 µm | Espectroscopia infrarroja | Identifica grupos de átomos en moléculas orgánicas, enlaces químicos y la estructura de la molécula. |
| Espectroscopia del infrarrojo cercano | |||
| Espectroscopia vibracional | |||
| Visible y ultravioleta | ×102 nm | Espectroscopia ultravioleta-visible | Mide la cantidad de compuestos orgánicos y metales. |
| Espectrofotometría | |||
| Espectroscopia Raman | Estudia las vibraciones de cristales y moléculas. | ||
| Espectroscopia de fluorescencia | Estudia moléculas que emiten luz y su entorno. | ||
| Espectroscopia de correlación de fluorescencia | |||
| Espectroscopia Brillouin | Estudia propiedades elásticas y magnéticas de materiales. | ||
| Rayos X | < 100 nm | Espectroscopia de absorción de rayos X (EXAFS y XANES) | EXAFS: Estudia el entorno de un átomo y sus vecinos cercanos.
XANES: Estudia el estado de oxidación y la forma en que los átomos se unen. |
| Espectroscopia de fotoelectrones emitidos por rayos X (XPS) | |||
| Espectroscopia de Fluorescencia de rayos X clásica y en reflexión total | Mide la cantidad de elementos químicos. | ||
| Microsonda de Castaing | Mide la cantidad de elementos químicos en áreas muy pequeñas. | ||
| Rayos gamma | 0.01 nm | Espectroscopia gamma | Identifica elementos radiactivos. |
| Espectroscopia Mössbauer | Estudia el estado de oxidación y el orden magnético. |
Otras técnicas de espectroscopia
- Espectrometría de masas (mide la masa de las moléculas)
- Espectrometría electrónica (estudia los electrones)
- Espectroscopía de resonancia (usa la resonancia para analizar materiales)
- Espectroscopía dieléctrica
- Espectroscopía de movilidad de iones
- Espectroscopía de dispersión de iones
- Espectroscopía de retrodispersión de Rutherford
- Espectroscopía de impedancia electroquímica
- Espectroscopía de eco de espín de neutrones
- Espectroscopia fotoacústica
- Espectrometría por antorcha de plasma
- Espectroscopia de resonancia acústica
La espectroscopia en astronomía
Espectroscopia astronómica es una técnica muy importante en la astronomía, especialmente usando luz ultravioleta, visible e infrarroja. Se divide en:
- La espectroscopía de rendija larga, que se usa para estudiar un solo objeto a la vez.
- La espectroscopía de escala, que permite obtener resultados muy detallados.
- La espectroscopía multiobjetos, que permite estudiar varios objetos al mismo tiempo, usando máscaras o fibras ópticas.
Galería de imágenes
Véase también
 En inglés: Spectroscopy Facts for Kids
En inglés: Spectroscopy Facts for Kids
- Dispersión inelástica de neutrones
- Espectro de frecuencias
- Espectrómetro
- Historia de la espectroscopia
- Métodos espectrométricos