Química inorgánica para niños
La química inorgánica es una rama de la química que estudia cómo se forman, de qué están hechos, cómo se estructuran y cómo reaccionan los elementos y los compuestos inorgánicos. Estos compuestos son, en general, aquellos que no tienen enlaces directos entre carbono e hidrógeno. Los que sí los tienen suelen ser estudiados por la química orgánica.
A veces, la diferencia entre química inorgánica y orgánica no es tan clara. Por ejemplo, la química organometálica combina aspectos de ambas.
Antiguamente, se pensaba que la materia viva tenía una "fuerza vital" especial que permitía crear moléculas orgánicas, y que estas no podían ser creadas artificialmente. Esta idea ya no se usa, y ahora sabemos que los químicos pueden crear muchas moléculas orgánicas en el laboratorio.
La química inorgánica es muy importante y se usa en muchos campos de la industria. Algunos ejemplos son:
- La catálisis, que ayuda a acelerar reacciones químicas.
- La ciencia de materiales, para crear nuevos materiales.
- Los pigmentos, que dan color a las cosas.
- Los recubrimientos, para proteger superficies.
- Los medicamentos.
- Los combustibles.
- La agricultura, por ejemplo, en los fertilizantes.
Contenido
- Conceptos clave de la química inorgánica
- Clasificación de los compuestos inorgánicos
- Química inorgánica teórica
- Termodinámica y química inorgánica
- Mecanismos en química inorgánica
- Caracterización de compuestos inorgánicos
- Química de síntesis inorgánica
- Clasificación de los compuestos inorgánicos
- Áreas de interés
- Áreas relacionadas
- Compuestos y sustancias importantes
- Galería de imágenes
- Véase también
Conceptos clave de la química inorgánica
Muchos compuestos inorgánicos son iónicos. Esto significa que están formados por iones (átomos con carga eléctrica) que se unen mediante enlaces iónicos. Hay iones positivos (llamados cationes) y iones negativos (llamados aniones).
Por ejemplo, el cloruro de magnesio (MgCl2) es una sal. Está hecho de iones de magnesio (Mg2+) y iones de cloruro (Cl−). Otro ejemplo es el óxido de sodio (Na2O), que tiene iones de sodio (Na+) y iones de oxígeno (O2−). En cualquier sal, las cargas de los iones se equilibran para que el compuesto sea eléctricamente neutro.
Los iones se describen por su estado de oxidación, que indica su carga. La facilidad con la que se forman se puede entender por la energía de ionización (para los cationes) o la afinidad electrónica (para los aniones) de los elementos originales.
Tipos de compuestos inorgánicos
Algunas clases importantes de compuestos inorgánicos son:
- Los óxidos.
- Los carbonatos.
- Los sulfatos.
- Los haluros.
Muchos compuestos inorgánicos tienen puntos de fusión altos. Las sales inorgánicas suelen ser malos conductores de electricidad cuando están en estado sólido. Otra característica importante es que muchos pueden cristalizar fácilmente. Algunos son muy solubles en agua (como el NaCl), mientras que otros no (como el AgCl).
Reacciones químicas inorgánicas
La reacción inorgánica más sencilla es el doble desplazamiento. Esto ocurre cuando se mezclan dos sales y sus iones se intercambian sin cambiar su estado de oxidación.
En las reacciones rédox, un reactivo (el oxidante) gana electrones y disminuye su estado de oxidación, mientras que otro (el reductor) pierde electrones y aumenta su estado de oxidación. El resultado es un intercambio de electrones. Este intercambio también puede ocurrir de forma indirecta, como en las baterías, que son clave en la electroquímica.
Cuando un reactivo tiene átomos de hidrógeno, puede haber una reacción de intercambio de protones, que es lo que ocurre en la química ácido-base. En un sentido más amplio, cualquier sustancia que puede aceptar pares de electrones se llama ácido de Lewis, y cualquier sustancia que puede donar pares de electrones se llama base de Lewis.
¿Dónde encontramos compuestos inorgánicos?
Los compuestos inorgánicos se encuentran en la naturaleza como minerales. Por ejemplo, el suelo puede contener pirita (sulfuro de hierro) o yeso (sulfato de calcio).
También son importantes en los seres vivos como biomoléculas:
- Como electrolitos (por ejemplo, el cloruro de sodio).
- En el almacenamiento de energía (como el ATP).
- En la construcción de estructuras (como el esqueleto de polifosfato en el ADN).
El primer compuesto inorgánico importante creado por el ser humano fue el nitrato de amonio, usado como fertilizante para el suelo, gracias al proceso de Haber. Algunos compuestos inorgánicos se fabrican para usarse como catalizadores (como el óxido de vanadio (V)) o como reactivos en química orgánica (como el hidruro de litio y aluminio).
Ramas de la química inorgánica
La química inorgánica tiene varias subdivisiones:
- Química organometálica: estudia compuestos con enlaces entre metales y carbono.
- Química de clústeres: estudia grupos de átomos unidos entre sí.
- Química bioinorgánica: estudia el papel de los elementos inorgánicos en los sistemas biológicos.
Estas áreas están en constante investigación para desarrollar nuevos catalizadores, superconductores y terapias.
Química inorgánica industrial
La química inorgánica es muy útil en la industria. Antiguamente, la producción de ácido sulfúrico era un indicador de la economía de un país.
Algunos de los productos químicos inorgánicos más importantes fabricados a nivel mundial son:
- Sulfato de aluminio
- Amoniaco
- Nitrato de amonio
- Sulfato de amonio
- Negro de carbón
- Cloro
- Ácido clorhídrico
- Hidrógeno
- Peróxido de hidrógeno
- Ácido nítrico
- Nitrógeno
- Oxígeno
- Ácido fosfórico
- Carbonato de sodio
- Clorato de sodio
- Hidróxido de sodio
- Silicato de sodio
- Sulfato de sodio
- Ácido sulfúrico
- Dióxido de titanio
La fabricación de fertilizantes es otra aplicación importante de la química inorgánica industrial.
Clasificación de los compuestos inorgánicos
La química inorgánica descriptiva clasifica los compuestos según sus propiedades. A menudo, esta clasificación se basa en la posición del elemento más pesado del compuesto en la tabla periódica, o en sus similitudes estructurales.
Compuestos de coordinación
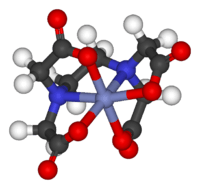
Los compuestos de coordinación clásicos tienen metales unidos a "pares solitarios" de electrones de átomos de otros elementos (llamados ligandos), como el agua (H2O) o el amoniaco (NH3). Hoy en día, casi cualquier compuesto orgánico o inorgánico puede ser un ligando. El "metal" suele ser de los grupos 3 al 13 de la tabla periódica.
La forma de estos complejos puede ser muy variada. Por ejemplo, Alfred Werner demostró que algunos complejos pueden tener formas que son imágenes especulares no superponibles, como nuestras manos (quiralidad), algo que antes se creía exclusivo de los compuestos orgánicos.
- Ejemplos: [Co(EDTA)]−, [Co(NH3)6]3+.
Compuestos de grupo principal

Estos compuestos contienen elementos de los grupos 1, 2, 13, 14, 15, 16, 17 y 18 de la tabla periódica (excepto el hidrógeno). A veces también se incluyen elementos de los grupos 3 y 12, así como los lantánidos y actínidos.
Muchos compuestos de grupo principal se conocen desde hace mucho tiempo, como el azufre o el fósforo blanco. Los experimentos de Lavoisier y Priestley con el oxígeno no solo identificaron este gas importante, sino que también ayudaron a describir los compuestos y las reacciones de forma más precisa. El descubrimiento de cómo producir amoniaco de forma práctica por Carl Bosch y Fritz Haber a principios del siglo XX fue muy importante para la humanidad.
- Ejemplos: Tetranitruro de tetraazufre (S4N4), diborano (B2H6), siliconas, buckminsterfullereno (C60).
Compuestos de metales de transición
Los compuestos con metales de los grupos 4 al 11 se consideran compuestos de metales de transición. A veces, los del grupo 3 o 12 también se incluyen aquí.
Estos compuestos tienen una química de coordinación muy diversa. Pueden tener formas como tetraédrica (por ejemplo, TiCl4), plana cuadrada o octaédrica. Algunos metales de transición son vitales en compuestos biológicos, como el hierro en la hemoglobina.
- Ejemplos: pentacarbonilo de hierro, tetracloruro de titanio, cisplatino.
Compuestos organometálicos
Los compuestos organometálicos suelen tener un enlace directo entre un metal y un átomo de carbono que forma parte de un grupo orgánico. El metal puede ser de un grupo principal o de transición.
Estos compuestos son especiales porque los grupos orgánicos suelen ser sensibles al agua o al oxígeno, lo que requiere métodos de preparación más específicos. La química organometálica es muy importante para la industria, especialmente en la petroquímica, ya que permite trabajar con moléculas como el hidrógeno (H2) o el nitrógeno (N2).
- Ejemplos: Ferroceno (Fe(C5H5)2), hexacarbonil molibdeno (Mo(CO)6).
Compuestos clúster (racimo)
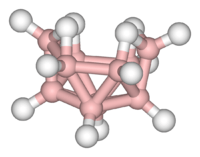
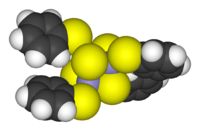
Los clústeres son grupos de átomos (al menos tres) que están directamente unidos entre sí. Se encuentran en todas las clases de compuestos químicos: inorgánicos "puros", organometálicos, de grupo principal y bioinorgánicos.
La diferencia entre un clúster muy grande y un sólido se está volviendo menos clara. Los clústeres grandes pueden verse como estructuras intermedias entre una molécula y un sólido, y son fundamentales en la nanotecnología.
- Ejemplos: Fe3(CO)12, B10H14, [Mo6Cl14]2−.
Compuestos bioinorgánicos
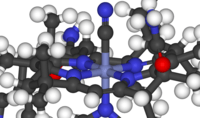
Estos compuestos se encuentran en la naturaleza, pero este campo también estudia sustancias creadas por el ser humano, como algunos contaminantes (por ejemplo, el metilmercurio) y medicamentos (por ejemplo, el cisplatino).
La química bioinorgánica abarca muchos tipos de compuestos, como los fosfatos en el ADN y complejos metálicos con péptidos o agua. Tradicionalmente, se ha centrado en cómo se transfieren electrones y energía en proteínas importantes para la respiración. La química inorgánica medicinal estudia elementos esenciales y no esenciales para aplicaciones de diagnóstico y tratamiento.
- Ejemplos: hemoglobina, metilmercurio, carboxipeptidasa.
Compuestos en estado sólido
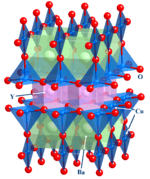
Esta área importante se enfoca en la estructura, los enlaces y las propiedades físicas de los materiales. La química inorgánica de estado sólido usa técnicas como la cristalografía para entender cómo las interacciones entre las partes de un sólido dan lugar a sus propiedades. Incluye el estudio de los metales y sus aleaciones.
- Ejemplos: chips de silicona, zeolitas, YBa2Cu3O7.
Química inorgánica teórica
La química inorgánica teórica usa modelos y herramientas de la química teórica y química computacional para entender cómo se forman los enlaces en las moléculas. Es difícil describir con precisión las moléculas con muchos electrones usando la mecánica cuántica. Por eso, se usan muchos métodos aproximados, como la teoría de orbitales moleculares y la teoría del campo del ligando.
Las excepciones a las teorías son muy importantes para el avance de este campo. Por ejemplo, el CuII2(OAc)4(H2O)2 es casi no magnético a temperatura ambiente, aunque la teoría del campo cristalino predeciría que debería tener dos electrones sin pareja. Esta diferencia entre la teoría y la observación llevó al desarrollo de nuevos modelos para el "acoplamiento magnético", lo que a su vez impulsó la creación de nuevos materiales magnéticos y tecnologías.
Teorías cualitativas
La química inorgánica se ha beneficiado mucho de las teorías cualitativas, que son más fáciles de aprender. Para los compuestos de grupo principal, la teoría TRePEV ayuda a predecir o explicar las estructuras, como por qué el NH3 es piramidal. Para los metales de transición, la teoría del campo cristalino ayuda a entender el magnetismo de muchos complejos simples, como por qué el [FeIII(CN)6]3− tiene solo un electrón sin pareja, mientras que el [FeIII(H2O)6]3+ tiene cinco.
Teoría de grupos y simetría molecular
Un concepto fundamental en química inorgánica es la simetría molecular. La teoría de grupos nos da el lenguaje para describir las formas de las moléculas según su simetría. También ayuda a simplificar los cálculos teóricos.
Las características que se ven en los espectros (como los colores que absorben o emiten las sustancias) se analizan usando las propiedades de simetría. Esto permite predecir cuántas absorciones y con qué intensidad aparecerán en los espectros.
La teoría de grupos también ayuda a ver las similitudes y diferencias entre el enlace en moléculas muy distintas, como el WF6 y el Mo(CO)6, o el CO2 y el NO2.
Termodinámica y química inorgánica
Otro enfoque en la química inorgánica se centra en las energías de las reacciones. Aunque es un enfoque más tradicional y basado en la experiencia, es muy útil. Conceptos como el potencial rédox, la acidez y los cambios de fase se expresan en términos termodinámicos. Un concepto clásico es el ciclo de Born-Haber, que se usa para calcular la energía de procesos básicos que no se pueden observar directamente, como la afinidad electrónica.
Mecanismos en química inorgánica
Un aspecto cada vez más importante de la química inorgánica es el estudio de cómo ocurren las reacciones, es decir, sus mecanismos. Los mecanismos de reacción se explican de forma diferente para cada tipo de compuesto.
Elementos del grupo principal y lantánidos
Los mecanismos de los compuestos de los grupos principales 13-18 a menudo se estudian junto con la química orgánica. Los elementos más pesados que el carbono, nitrógeno, oxígeno y flúor a veces forman compuestos con más electrones de los que predice la regla del octeto, como se explica en el artículo sobre moléculas hipervalentes. Por esta razón, los mecanismos de sus reacciones son diferentes a los de los compuestos orgánicos.
Los elementos más ligeros que el carbono (como el boro, berilio, litio), así como el aluminio y el magnesio, a menudo forman estructuras con pocos electrones, parecidas a los carbocationes. Estas sustancias tienden a reaccionar de formas específicas. La química de los lantánidos es similar en muchos aspectos a la del aluminio.
Complejos de metales de transición
Los mecanismos de las reacciones de los metales de transición se estudian de forma diferente a los de los compuestos de grupo principal. El papel importante de los orbitales d en el enlace influye mucho en cómo los ligandos se unen o se separan. Se observan vías de reacción tanto asociativas como disociativas.
Un aspecto general de la química de mecanismos de los metales de transición es la facilidad con la que un complejo puede intercambiar ligandos. Por ejemplo, el intercambio de agua libre y unida en los complejos [M(H2O)6]n+:
- [M(H2O)6]n+ + 6 H2O* → [M(H2O*)6]n+ + 6 H2O
- donde H2O* es agua con un isótopo diferente, como H217O.
Las velocidades de intercambio de agua varían enormemente en la tabla periódica, siendo los complejos de lantánidos muy rápidos y los de iridio (III) muy lentos.
Reacciones rédox
Las reacciones rédox son muy comunes en los elementos de transición. Hay dos tipos principales: las reacciones de transferencia de átomos (como la adición oxidativa/eliminación reductiva) y las de transferencia de electrones. Una reacción rédox básica es el "autointercambio", donde un oxidante y un reductor intercambian un electrón. Por ejemplo, el permanganato y el manganato (su forma reducida) intercambian un electrón:
- [MnO4]− + [Mn*O4]2− → [MnO4]2− + [Mn*O4]−
Reacciones en los ligandos
Los ligandos unidos a un metal reaccionan de forma diferente a cuando están libres. Por ejemplo, el amoniaco unido a [Co(NH3)6]3+ es más ácido que el amoniaco libre. Los alquenos unidos a cationes metálicos reaccionan con sustancias que donan electrones (nucleófilos), algo que los alquenos normales no hacen.
El campo de la catálisis, que es muy amplio e importante para la industria, se basa en la capacidad de los metales para cambiar la forma en que reaccionan los ligandos orgánicos. La catálisis homogénea ocurre en una sola fase (por ejemplo, en solución), mientras que la catálisis heterogénea ocurre cuando los gases o sustancias disueltas interactúan con la superficie de un sólido. Los metales de transición, casi exclusivamente, reaccionan con moléculas pequeñas como CO, H2, O2 y C2H4. La importancia industrial de estas materias primas impulsa la investigación en catálisis. Los ligandos también pueden sufrir reacciones de transferencia, como la transmetalación.
Caracterización de compuestos inorgánicos
Como los compuestos inorgánicos están hechos de una gran variedad de elementos y tienen muchas propiedades diferentes, su estudio está muy ligado a diversos métodos de análisis. Los métodos más antiguos examinaban propiedades generales como la conductividad eléctrica, los puntos de fusión, la solubilidad o la acidez.
Con el avance de la teoría cuántica y los equipos electrónicos, se han desarrollado nuevas herramientas para estudiar las propiedades electrónicas de las moléculas y sólidos inorgánicos. Estas mediciones a menudo dan información útil para los modelos teóricos. Por ejemplo, las mediciones en el espectro fotoelectrónico del metano mostraron que la descripción de los enlaces usando la teoría del enlace de valencia no era suficiente para explicar los procesos de ionización de forma sencilla. Esto llevó a que la teoría de los orbitales moleculares, que describe los electrones de forma más extendida, se hiciera más popular.
Las técnicas más comunes para caracterizar compuestos inorgánicos son:
- Cristalografía de rayos X: Permite determinar la estructura tridimensional de las moléculas.
- Interferómetro de polarización dual: Mide la forma y los cambios de forma de las moléculas.
- Varias formas de espectroscopia:
- Espectroscopia ultravioleta-visible: Ha sido muy importante porque muchos compuestos inorgánicos tienen colores intensos.
- Espectroscopía de RMN: Además de los núcleos de 1H y 13C, muchos otros núcleos (como 11B, 19F, 31P y 195Pt) dan información importante sobre las propiedades y la estructura de los compuestos. También es útil para estudiar sustancias magnéticas.
- Espectroscopia infrarroja: Se usa principalmente para detectar absorciones de ligandos carbonílicos.
- Espectroscopia de doble resonancia nuclear electrónica (ENDOR).
- Espectroscopia de Mössbauer.
- Resonancia de espín electrónico (ESR o EPR): Permite medir el entorno de los centros metálicos paramagnéticos.
- Electroquímica: Técnicas como la voltametría cíclica detectan las propiedades rédox de los compuestos.
Química de síntesis inorgánica
Aunque algunas sustancias inorgánicas se pueden obtener puras de la naturaleza, la mayoría se fabrican en plantas químicas y en laboratorios.
Los métodos de síntesis inorgánica se pueden clasificar según si los reactivos son volátiles o solubles. Los compuestos inorgánicos solubles se preparan usando métodos similares a los de la síntesis orgánica. Para compuestos que reaccionan con el aire, se usan técnicas especiales como la línea de Schlenk y la caja de guantes.
Los compuestos volátiles y los gases se manejan en "colectores de vacío", que son tubos de vidrio conectados por válvulas, donde se puede hacer un vacío muy alto. Los compuestos se enfrían usando nitrógeno líquido u otros criogénicos para condensarlos. Los sólidos se suelen preparar en hornos de tubo, con los reactivos y productos sellados en recipientes, a menudo de sílice fundida o materiales más especializados. Los productos y reactivos se mueven entre zonas de diferentes temperaturas para que las reacciones ocurran.
Clasificación de los compuestos inorgánicos
Los compuestos inorgánicos se dividen según su estructura en:
Compuestos binarios
- Óxidos metálicos
- Óxidos no metálicos o anhídridos
Compuestos ternarios
- Hidróxidos
- Oxoácidos
- Oxisales neutras
Compuestos cuaternarios
- Oxisales ácidas
Áreas de interés
Algunas áreas importantes de la química inorgánica son:
- La tabla periódica de los elementos:
- Elementos representativos
- Metales de transición
- Tierras raras
- Química de coordinación
- Química de los compuestos con enlace metal-metal
Áreas relacionadas
La química inorgánica se relaciona con otros campos del conocimiento, como:
- Ciencia de materiales
- Geoquímica
- Magnetoquímica
- Mineralogía
- Química analítica
- Química bioinorgánica
- Química del estado sólido
- Química física
- Química medioambiental
- Química organometálica
Compuestos y sustancias importantes
Hay muchos compuestos y sustancias inorgánicas que son muy importantes, tanto comercialmente como biológicamente. Algunos de ellos son:
- Muchos fertilizantes, como el nitrato amónico, nitrato potásico, fosfatos o sulfatos.
- Muchas sustancias y disolventes de uso diario, como el amoniaco, el agua oxigenada, la lejía o el salfumán.
- Muchos gases de la atmósfera, como el oxígeno, el nitrógeno, el dióxido de carbono, los óxidos de nitrógeno y los óxidos de azufre.
- Todos los metales y aleaciones.
- Los vidrios de ventanas, botellas y televisores.
- Las cerámicas de utensilios domésticos, industriales o las losetas de las lanzaderas espaciales.
- El carbonato de calcio de nuestros huesos.
- Los chips de silicio semiconductores que hacen posible la microelectrónica y los ordenadores.
- Las pantallas LCD.
- El cable de fibra óptica.
- Muchos catalizadores de interés industrial.
- El centro activo de las metaloenzimas.
Galería de imágenes
-
Los compuestos inorgánicos muestran una rica variedad:
A: El Diborano cuenta con un enlace inusual.
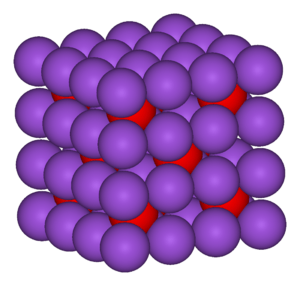
B: El cloruro de cesio tiene una estructura cristalina arquetípica.
C: El Fp2 es un complejo organometálico. D: Las siliconas se usan en muchos productos, desde materiales médicos hasta el Silly Putty.
E: El catalizador de Grubbs ganó el Premio Nobel 2005 por su descubridor.
F: Las zeolitas se usan mucho como tamices moleculares.
G: El acetato de cobre (II) sorprendió a los teóricos con su diamagnetismo. -
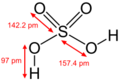
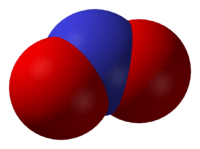
Molécula del ácido sulfúrico representada en 2 dimensiones, un compuesto químico inorgánico muy utilizado.
Véase también
 En inglés: Inorganic chemistry Facts for Kids
En inglés: Inorganic chemistry Facts for Kids
- IUPAC
- Nomenclatura
- Nomenclatura química de los compuestos inorgánicos
- Nomenclatura química de los compuestos orgánicos