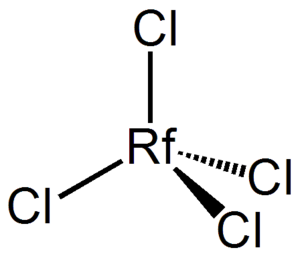Rutherfordio para niños
Datos para niños Lawrencio ← Rutherfordio → Dubnio |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Rutherfordio, Rf, 104 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Metales de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 4, 7, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | [261] u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Rn] 5f14 6d2 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Desconocido; probablemente metálico, plateado blanco o gris |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Presuntamente sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El rutherfordio (antes conocido como kurchatovio) es un elemento químico que se encuentra en la tabla periódica. Su símbolo es Rf y su número atómico es 104.
Este elemento fue nombrado en honor a Ernest Rutherford, un famoso científico que hizo importantes descubrimientos sobre el átomo y la física nuclear. El rutherfordio es un elemento sintético, lo que significa que no se encuentra de forma natural, sino que es creado por los científicos. Es muy radiactivo y su isótopo más estable, el 261Rf, dura muy poco tiempo, aproximadamente 13 horas.
En la tabla periódica, el rutherfordio pertenece al bloque d y es parte de los metales de transición. Se encuentra en el período 7 y en el grupo 4. Los experimentos han demostrado que el rutherfordio se comporta de manera similar al hafnio, otro elemento del grupo 4.
En la década de 1960, se crearon pequeñas cantidades de rutherfordio en el Instituto Conjunto de Investigación Nuclear en la Unión Soviética y en el Laboratorio Nacional Lawrence Berkeley en California. Hubo una discusión entre los científicos de la Unión Soviética y los de Estados Unidos sobre quién lo descubrió primero y, por lo tanto, quién tenía derecho a nombrarlo. Finalmente, en 1997, la Unión Internacional de Química Pura y Aplicada (IUPAC) decidió que el nombre oficial sería rutherfordio.
Contenido
Historia del Rutherfordio
El rutherfordio fue creado por primera vez en 1964 en el Instituto Conjunto para la Investigación Nuclear en Dubna, Rusia. Los científicos allí bombardearon plutonio con iones de neón a alta velocidad. Observaron señales que indicaban la formación de un nuevo elemento.
En 1969, investigadores de la Universidad de California, Berkeley, en Estados Unidos, también crearon el elemento. Lo hicieron al chocar átomos de californio (249Cf) con átomos de carbono (12C) a muy alta energía. El grupo de Berkeley no pudo repetir el método que usaron los científicos soviéticos.
¿Por qué hubo una disputa por el nombre?
Debido a que ambos grupos afirmaron haberlo descubierto, surgió una disputa sobre cómo llamar al elemento. Los científicos soviéticos propusieron "Dubnio" (Db), por la ciudad de Dubna, o "Kurchatovio" (Ku), en honor a Ígor Kurchátov, un líder en la investigación nuclear soviética. Los científicos estadounidenses, por su parte, propusieron "Rutherfordio" (Rf), en honor a Ernest Rutherford.
Para resolver esta situación, la Unión Internacional de Química Pura y Aplicada (IUPAC) usó un nombre temporal, Unnilquadium (Unq), hasta que en 1997 se llegó a un acuerdo y se adoptó el nombre actual de Rutherfordio.
¿Cómo se comporta el Rutherfordio?
Se han podido estudiar muy pocas propiedades del rutherfordio. Esto se debe a que es muy difícil y costoso de producir, y además se descompone muy rápido. La mayoría de sus propiedades se han predicho basándose en cálculos científicos.
Propiedades Químicas del Rutherfordio
El rutherfordio es el primer elemento de la serie 6d de los metales de transición. Los cálculos sugieren que sus propiedades químicas son muy parecidas a las del hafnio, zirconio y titanio, que también están en el grupo 4 de la tabla periódica.
Se espera que el rutherfordio forme compuestos estables con un estado de oxidación de +4, al igual que el hafnio. También podría formar un estado +3, aunque sería menos estable.
Los científicos han realizado experimentos para entender cómo reacciona el rutherfordio. Por ejemplo, se cree que forma un óxido muy estable, RfO2. También reacciona con elementos como el cloro para formar compuestos llamados tetrahaluros, como el RfCl4. Estos compuestos son volátiles y se pueden convertir en gas fácilmente.
En soluciones líquidas, el rutherfordio se comporta de manera similar al hafnio y al zirconio. Puede formar iones complejos, como el hexaclororutherfordato ([RfCl6]2−) cuando se mezcla con iones de cloruro.
Propiedades Físicas y Atómicas
Se cree que el rutherfordio es un sólido a temperatura ambiente. Se espera que sea un metal pesado, con una densidad de aproximadamente 17 gramos por centímetro cúbico. Su tamaño atómico (radio atómico) se estima en unos 150 picómetros.
Bajo presiones muy altas, se predice que el rutherfordio cambiará su estructura cristalina. Esto es similar a lo que ocurre con el hafnio, su elemento "vecino" en la tabla periódica.
Química Experimental del Rutherfordio
| Fórmula | Nombres |
|---|---|
| RfCl4 | tetracloruro de rutherfordio, cloruro de rutherfordio(IV) |
| RfBr4 | tetrabromuro de rutherfordio, bromuro de rutherfordio(IV) |
| RfOCl2 | oxicloruro de rutherfordio, cloruro de rutherfordilo(IV), rutherfordio(IV) dichloride oxide |
| [RfCl6]2− | hexaclororutherfordato(IV) |
| [RfF6]2− | hexafluorutherfordato(IV) |
| K2[RfCl6] | potasio hexaclororutherfordatoe(IV) |
Estudios en Fase Gaseosa
Los primeros estudios sobre la química del rutherfordio se hicieron usando una técnica llamada termocromatografía de gases. Esto ayuda a medir cómo se depositan los compuestos a diferentes temperaturas. Se usó el isótopo 261mRf para estos estudios.
Los experimentos confirmaron que el rutherfordio se comporta como un elemento típico del grupo 4. Forma un cloruro (RfCl4) y un bromuro (RfBr4) que pueden convertirse en gas. También forma un oxicloruro (RfOCl2). Se ha visto que el cloruro de rutherfordio (IV) es más volátil que el cloruro de hafnio (IV) porque sus enlaces son más covalentes.
Estudios en Solución Líquida
Se cree que el rutherfordio tiene una configuración electrónica que lo hace comportarse como el "hermano mayor" del hafnio en el grupo 4. Por eso, debería formar fácilmente un ion Rf4+ en soluciones ácidas fuertes. También debería formar complejos en soluciones de ácido clorhídrico, ácido bromhídrico o ácido fluorhídrico.
Los estudios más importantes sobre la química del rutherfordio en soluciones líquidas fueron realizados por un equipo japonés. Compararon el rutherfordio con el hafnio, el zirconio y el torio. Los resultados mostraron que el rutherfordio se comporta como un elemento del grupo 4. Esto incluye la formación de un complejo llamado hexaclororutherfordato en soluciones de cloruro, similar a lo que hacen el hafnio y el zirconio.
- 261m
Rf4+
+ 6 Cl−
→ [261mRfCl
6]2−
También se observaron resultados parecidos en soluciones de ácido fluorhídrico. Las diferencias en cómo se extraían los elementos sugirieron que el rutherfordio tiene una menor afinidad por el ion fluoruro y forma el ion hexafluororutherfordato.
- 261m
Rf4+
+ 6 F−
→ [261mRfF
6]2−
Véase también
 En inglés: Rutherfordium Facts for Kids
En inglés: Rutherfordium Facts for Kids
- Controversia sobre el nombre de los elementos 104 al 108