Indio (elemento) para niños
Datos para niños Cadmio ← Indio → Estaño |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Indio, In, 49 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Metales del bloque p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 13, 5, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 114,818 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Kr] 4d10 5s2 5p1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Mohs | 1,2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 18, 3 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Lustroso plateado grisáceo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 155 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,78 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 156 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 144 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de van der Waals | 193 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óxido | Anfótero | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 558,3 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 1820,7 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª energía de ionización | 2704 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª energía de ionización | 5210 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 7310 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 429,75 K (157 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 2345 K (2072 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 231,5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 3,263 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 1,42 × 10-17 Pa a 429 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Tetragonal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 233 J/(kg·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | 11,6 × 106 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 81,6 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 1215 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del indio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El indio es un elemento químico con el número atómico 49. Lo puedes encontrar en el grupo 13 y el período 5 de la tabla periódica de los elementos. Su símbolo es In. Es un metal que no es muy común, es fácil de moldear y se derrite con facilidad. Se parece químicamente al aluminio y al galio, pero más al zinc. De hecho, la mayor parte del indio se obtiene de los minerales de zinc. Su uso más importante hoy en día es en las pantallas táctiles, donde se usa una mezcla de óxido de indio y estaño.
Contenido
Historia del Indio: ¿Quién lo Descubrió?
El indio fue descubierto en 1863 por los científicos Ferdinand Reich y Theodor Richter. Ellos estaban buscando otro elemento, el talio, en unos minerales de zinc usando un aparato llamado espectrógrafo. Richter logró aislar el indio puro en 1867.
Propiedades del Indio: ¿Cómo es este Metal?
Propiedades Físicas del Indio
El indio es un metal de color blanco plateado y tiene un brillo especial. Es muy dúctil, lo que significa que se puede estirar y moldear fácilmente. Es tan blando (su dureza Mohs es de 1,2) que puedes cortarlo con un cuchillo, ¡como si fuera mantequilla! También deja una marca visible si lo frotas en papel.
El indio pertenece al grupo del boro en la tabla periódica. Sus características son una mezcla entre las de sus vecinos, el galio y el talio. Al igual que el estaño, cuando doblas el indio, puedes escuchar un sonido crujiente. Esto se debe a cómo se organizan sus cristales por dentro.
Una curiosidad es que, al igual que el galio, el indio puede "mojar" el vidrio, es decir, se adhiere a su superficie. El indio tiene un punto de fusión bajo, de 156,60 °C. Esto es más alto que el galio, pero más bajo que el talio y el estaño. Su punto de ebullición es de 2072 °C.
La densidad del indio es de 7,31 gramos por centímetro cúbico. Esto es más que el galio, pero menos que el talio. Si se enfría mucho, por debajo de los 3,41 K, el indio se vuelve superconductor, lo que significa que puede conducir la electricidad sin ninguna resistencia.
Propiedades Químicas del Indio
El indio tiene 49 electrones. En la mayoría de los compuestos, el indio tiende a ceder sus tres electrones más externos para formar el ion indio(III), In3+. A veces, solo cede un electrón, formando indio(I), In+.
El indio metálico no reacciona con el agua. Sin embargo, si lo pones en contacto con sustancias más fuertes, como los halógenos, se oxida y forma compuestos de indio(III). El indio no forma compuestos con el boro, el silicio o el carbono.
Isótopos del Indio
El indio tiene 39 isótopos conocidos, que son diferentes versiones del mismo elemento. De forma natural, solo encontramos dos:
- Indio-113: Es el único isótopo estable del indio.
- Indio-115: Aunque es radiactivo, tiene una vida media increíblemente larga, de 4,41 seguido de 14 ceros años. Esto es mucho más que la edad del Universo. Este isótopo forma el 95,7% de todo el indio que existe.
El isótopo artificial más estable es el indio-111, con una vida media de unos 2,8 días. Los isótopos de indio más ligeros que el indio-115 se transforman principalmente en isótopos de cadmio. Los isótopos de indio más pesados que el indio-115 se transforman en isótopos de estaño.
Usos y Aplicaciones del Indio
El indio se usó mucho durante la Segunda Guerra Mundial para recubrir motores de aviones de alto rendimiento. Hoy en día, tiene muchas otras aplicaciones:
- Pantallas Táctiles: Es su uso más importante. El óxido de indio y estaño se usa para fabricar los electrodos transparentes de las pantallas táctiles de teléfonos móviles, tabletas y otros dispositivos. También fue clave para lograr el color azul en los LED.
- Aleaciones: Se mezcla con otros metales para crear aleaciones con un punto de fusión muy bajo. Por ejemplo, una aleación con 24% de indio y 76% de galio es líquida a temperatura ambiente.
- Electrónica: Se usa en la fabricación de fotoconductores, transistores de germanio, rectificadores y termistores.
- Espejos: Se puede aplicar sobre otros metales o evaporar sobre vidrio para crear espejos tan buenos como los de plata, pero que resisten mejor la corrosión.
- Paneles Electroluminiscentes: Su óxido se utiliza para fabricar estos paneles que emiten luz.
- Medicina Nuclear: Un isótopo radiactivo del indio, el 111 In, se usa en medicina para ayudar a diagnosticar ciertos tipos de cáncer mediante imágenes.
¿Dónde se Encuentra y Cómo se Produce el Indio?
Se calcula que en la corteza terrestre hay alrededor de 0,24 ppm de indio, una cantidad similar a la de la plata. El principal país productor de indio es China.
Los minerales que contienen indio son muy escasos, por lo que no se extraen solo para obtener indio. El indio se obtiene como un subproducto cuando se procesan otros metales, principalmente los minerales de zinc y, en menor medida, los de cobre. Durante el proceso de fundición del zinc, el indio se acumula en los residuos y de ahí se puede extraer. Luego se purifica usando electrólisis.
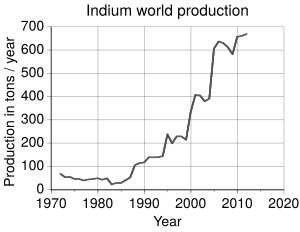
Debido a que es un subproducto, la cantidad de indio que se produce depende de cuánto zinc y cobre se extraen cada año. Se estima que se podrían obtener al menos 1.300 toneladas de indio al año de los minerales de zinc y 20 toneladas de los de cobre. Esto es más de lo que se produce actualmente (655 toneladas en 2016).
Se ha hablado de que el indio podría escasear antes de 2050. Por eso, se investiga mucho para encontrar materiales que puedan reemplazar al óxido de indio y estaño en las pantallas táctiles. Se cree que láminas muy delgadas de grafeno podrían ser una buena alternativa. La empresa coreana Samsung ya ha hecho prototipos de pantallas táctiles con grafeno, pero aún se necesita más investigación para que funcionen tan bien como las actuales.
Precauciones con el Indio
Aunque no hay pruebas definitivas, se cree que el indio tiene una toxicidad baja. En las industrias donde se usa mucho, como la de semiconductores, no se han reportado problemas de salud graves. Sin embargo, se necesitan más estudios para confirmarlo.
Véase también
 En inglés: Indium Facts for Kids
En inglés: Indium Facts for Kids