Modelo atómico de Thomson para niños
El modelo atómico de Thomson es una idea sobre cómo se ve un átomo, propuesta en 1904 por Joseph John Thomson. Él fue quien descubrió el electrón en 1897. En este modelo, el átomo se parece a un "pudín de pasas". Imagina una esfera grande con carga positiva, y dentro de ella, como si fueran pasas, están los electrones, que tienen carga negativa.
Thomson pensó que los electrones estaban distribuidos de manera uniforme por todo el átomo. El átomo completo se veía como una esfera positiva con pequeños electrones negativos esparcidos por dentro.
Contenido
¿Qué es el Modelo Atómico de Thomson?
Desde hace mucho tiempo, los científicos sabían que los átomos tenían partículas con carga negativa. Thomson las llamó "corpúsculos", pero hoy las conocemos como "electrones". También se sabía que los átomos no tienen una carga eléctrica total, es decir, son neutros. Por eso, Thomson pensó que los átomos debían tener también una carga positiva que equilibrara la carga negativa de los electrones.
Thomson publicó su idea en una revista científica importante en marzo de 1904. Él creía que los átomos estaban formados por muchas partículas negativas (electrones) dentro de una esfera grande de carga positiva uniforme.
¿Cómo se desarrolló el modelo de Thomson?
J.J. Thomson se basó en las ideas de otros científicos, como Lord Kelvin (William Thomson), quien había propuesto un modelo de átomo con una esfera positiva un año antes. Thomson era un científico muy práctico y basó su modelo en lo que se sabía por experimentos en ese momento. Su idea ayudó a guiar futuros experimentos.
En este modelo, los electrones podían moverse en círculos dentro de la esfera positiva. Se pensaba que estas órbitas eran estables porque la carga positiva de la esfera los mantenía en su lugar.
¿Por qué fue importante el modelo de Thomson?
El modelo de Thomson fue muy útil porque ayudó a su estudiante, Ernest Rutherford, a diseñar experimentos para investigar más a fondo cómo estaban hechos los átomos.
Además, el modelo de Thomson fue una mejora respecto a ideas anteriores, como los modelos que imaginaban el átomo como un pequeño sistema solar. Esos modelos no eran estables según las leyes de la física de la época, porque los electrones se caerían hacia el centro. El modelo de Thomson, en cambio, sí era estable.
Todos estos modelos atómicos, incluido el de Thomson, fueron pasos importantes que llevaron a modelos más precisos, como el Modelo de Bohr de 1913.
¿De dónde viene el nombre "pudín de pasas"?
El nombre "pudín de pasas" se le dio al modelo de Thomson porque la forma en que los electrones estaban distribuidos en la esfera positiva recordaba a muchos científicos las pasas en un postre inglés llamado plum pudding (pudín de ciruelas o pasas).
¿Qué experimentos desafiaron el modelo de Thomson?
En 1909, Hans Geiger y Ernest Marsden hicieron experimentos con láminas muy finas de oro. Su profesor, Ernest Rutherford, esperaba que los resultados coincidieran con el modelo de Thomson.
Sin embargo, en 1911, Rutherford interpretó los resultados de manera diferente. Descubrió que la carga positiva de un átomo no estaba esparcida por toda la esfera, sino que estaba concentrada en una región muy pequeña en el centro. A esta región se le llamó más tarde núcleo atómico. Este descubrimiento llevó al desarrollo del Modelo atómico de Rutherford.
Éxitos del modelo atómico de Thomson
Este modelo fue muy importante porque usó la información obtenida de los estudios con rayos catódicos a finales del siglo XIX. Antes, el modelo de Dalton decía que los átomos eran indivisibles. Pero los rayos catódicos mostraron que los átomos contenían partículas eléctricas con carga negativa.
El modelo de Thomson no solo mantenía las ideas válidas del modelo de Dalton, sino que también podía explicar lo que se veía en los experimentos con rayos catódicos.
Limitaciones del modelo de Thomson
Aunque el modelo de Thomson explicaba muchas cosas de la química y los rayos catódicos, no predecía correctamente cómo estaba distribuida la carga positiva dentro de los átomos.
Las predicciones del modelo de Thomson no coincidían con los resultados del experimento de Rutherford. Este experimento demostró que la carga positiva estaba concentrada en una pequeña parte central del átomo, lo que hoy conocemos como núcleo atómico. El modelo atómico de Rutherford pudo explicar esto.

Otro aspecto que el modelo de Thomson no explicaba era la organización de la tabla periódica de Mendeleiev. Modelos posteriores, como los de Bohr, Sommerfeld y Schrödinger, finalmente explicaron por qué los elementos se comportan de forma periódica. Esto se debe a una forma más organizada en que los electrones se distribuyen en el átomo, algo que ni el modelo de Thomson ni el de Rutherford habían considerado.
Problemas científicos relacionados
El modelo del pudín de pasas, como un ejemplo importante de modelo científico, inspiró y guio la investigación de varios problemas científicos.
Tamaño del átomo y constantes científicas
El físico Arthur Erich Haas usó el modelo del pudín de pasas (con un solo electrón) en 1910 para calcular el valor de la constante de Planck y el radio de Bohr para los átomos de hidrógeno. El trabajo de Haas fue el primero en estimar estos valores con una buena precisión, incluso antes que el trabajo de Niels Bohr.
El problema matemático de Thomson
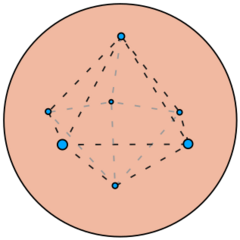
Un problema matemático interesante relacionado con el modelo del pudín de pasas es cómo distribuir de la mejor manera puntos con la misma carga en una esfera. Esto se conoce como el problema de Thomson.
Véase también
 En inglés: Plum pudding model Facts for Kids
En inglés: Plum pudding model Facts for Kids
- Teoría atómica
- Modelo atómico de Rutherford
- Modelo atómico de Bohr
- Modelo atómico de Sommerfeld
- Modelo atómico de Schrödinger
- Modelo atómico de Dalton