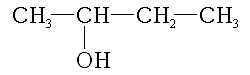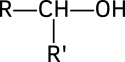Alcohol para niños
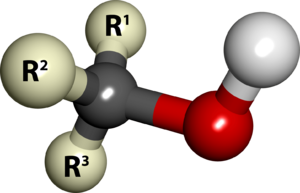
En química, un alcohol es un tipo de compuesto orgánico que tiene un grupo especial llamado grupo hidroxilo (-OH). Este grupo -OH reemplaza a un átomo de hidrógeno en una molécula de alcano. El grupo -OH está unido a un átomo de carbono mediante un enlace covalente. Es importante que este carbono esté "saturado", lo que significa que solo tiene enlaces sencillos con otros átomos. Esto ayuda a diferenciar a los alcoholes de otros compuestos similares llamados fenoles.
Si un compuesto tiene varios grupos hidroxilo, se le llama polialcohol o poliol. Los polioles son sustancias con una cadena de carbonos, y cada carbono tiene un grupo -OH. Muchos polioles importantes se obtienen en la industria a partir de azúcares, usando hidrógeno y un catalizador como el níquel. Los alcoholes se pueden clasificar según dónde esté el grupo hidroxilo:
- Alcoholes primarios: El grupo hidroxilo está en un carbono unido a un solo carbono más.
- Alcoholes secundarios: El grupo hidroxilo está en un carbono unido a dos carbonos más.
- Alcoholes terciarios: El grupo hidroxilo está en un carbono unido a tres carbonos más.
Los alcoholes son muy comunes en la naturaleza y cumplen funciones importantes en los seres vivos. También son muy útiles en la síntesis orgánica (la creación de nuevas moléculas) debido a sus propiedades químicas únicas. En la industria, los alcoholes tienen muchas aplicaciones, por ejemplo, como disolventes o combustibles.
Contenido
¿De dónde viene la palabra "alcohol"?
La palabra "alcohol" viene del latín medieval alcohol, que significaba un polvo muy fino, como el que se usaba para maquillarse los ojos. Esta palabra latina, a su vez, viene del árabe hispánico al-kuḥúl, que se refería a un polvo hecho de estibio. La palabra árabe original, al-kuḥl o al-ghawl, significaba "el espíritu" o "toda sustancia pulverizada" o "líquido destilado".
Historia de los alcoholes
Los persas ya conocían el alcohol obtenido por destilación del vino en el siglo IX. El alquimista persa Muhammad ibn Zakarīyā al-Rāzī mejoró los métodos de destilación. En Europa, el descubrimiento del alcohol se atribuye al médico y alquimista Arnau de Villanova a principios del siglo XIV.
Más tarde, Lavoisier explicó cómo se produce el alcohol a través de la fermentación. Demostró que, con la ayuda de la levadura, el azúcar de la uva se convierte en ácido carbónico y alcohol. Otros científicos como Scheele, Thénard, Duma y Boullay también estudiaron los alcoholes. En 1854, Berthelot logró crear alcohol en un laboratorio.
Química de los alcoholes
¿Cómo se nombran los alcoholes?
Los alcoholes se pueden nombrar de varias maneras:
- Nombre común (no sistemático): Se usa la palabra "alcohol" seguida del nombre del alcano del que proviene, cambiando la terminación "-ano" por "-ílico".
* Por ejemplo: Metano → alcohol metílico * Etano → alcohol etílico * Propano → alcohol propílico
- Nomenclatura IUPAC: Esta es la forma oficial y más usada en química. Se añade la letra "l" al final del nombre del hidrocarburo del que proviene.
* Por ejemplo: Metano → metanol * Aquí, "met-" indica un solo átomo de carbono, "-ano-" indica que es un hidrocarburo alcano, y "-l" indica que es un alcohol.
A veces, es necesario indicar la posición del carbono al que está unido el grupo hidroxilo. Por ejemplo, en el 2-butanol, el número "2" indica que el grupo hidroxilo está en el segundo carbono de la cadena. El prefijo "but-" significa que la cadena tiene cuatro carbonos, y la "-l" indica que es un alcohol. Cuando el grupo alcohol es un sustituyente en una molécula más grande, se usa el prefijo "hidroxi-". Si hay varios grupos -OH, se usan sufijos como "-diol" (para dos), "-triol" (para tres), etc.
Para más detalles, puedes consultar Nomenclatura de funciones orgánicas con oxígeno#Hidroxicompuestos: alcoholes, fenoles y polioles.
Ejemplos de alcoholes
- Etanol:
- Butan-2-ol:
Tipos de alcoholes
En general, un alcohol tiene la estructura:
- R - OH
Donde "R" es una parte orgánica variable de la molécula, a menudo un alquilo.
Según el tipo de carbono al que se une el grupo hidroxilo, los alcoholes se clasifican en:
- Alcoholes primarios: El carbono que tiene el grupo hidroxilo está unido a al menos dos átomos de hidrógeno y a un radical orgánico (R).
- Alcoholes secundarios: El carbono que tiene el grupo hidroxilo está unido a un átomo de hidrógeno y a dos radicales orgánicos (R y R').
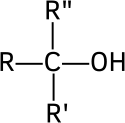
- Alcoholes terciarios: El carbono que tiene el grupo hidroxilo está unido a tres radicales orgánicos (R, R′ y R″).
- Los fenoles a veces se consideran un tipo especial de alcohol, donde el grupo hidroxilo está unido a un carbono de un anillo bencénico. Sin embargo, su forma de reaccionar es tan diferente que generalmente se estudian aparte de los alcoholes.
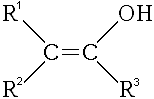
- También existen los enoles, donde el grupo hidroxilo está unido a un carbono que forma parte de un doble enlace C=C. Los enoles suelen transformarse rápidamente en aldehídos o cetonas, que son formas más estables.
Fórmula general
Los monoalcoholes (con un solo grupo -OH) que provienen de los alcanos tienen la fórmula general CnH2n+1OH.
Propiedades de los alcoholes
Los alcoholes suelen ser líquidos sin color y con un olor particular. Se mezclan con el agua en diferentes proporciones y son menos densos que ella. A medida que las moléculas de alcohol se hacen más grandes, sus puntos de fusión y ebullición aumentan, y algunos pueden ser sólidos a temperatura ambiente.
A diferencia de los alcanos, el grupo hidroxilo (-OH) de los alcoholes les permite mezclarse con el agua. Esto se debe a que el grupo -OH es similar a la molécula de agua y puede formar enlaces de hidrógeno con ella. La capacidad de un alcohol para mezclarse con el agua depende del tamaño y la forma de su cadena de carbonos: cuanto más larga y grande sea la cadena, menos se parecerá a una molécula de agua y menos se mezclará con ella.
Los enlaces de hidrógeno también afectan los puntos de fusión y ebullición de los alcoholes. Aunque estos enlaces son débiles, se forman muchos entre las moléculas, creando una red que hace más difícil que las moléculas cambien de estado (de sólido a líquido o de líquido a gas). Por eso, los alcoholes tienen puntos de fusión y ebullición más altos que los alcanos de tamaño similar. Además, la diferencia entre sus puntos de fusión y ebullición suele ser grande, lo que los hace útiles en mezclas anticongelantes. Por ejemplo, el 1,2-etanodiol se funde a -16 °C y hierve a 197 °C.
Apariencia
Los alcoholes con moléculas pequeñas son líquidos sin color a temperatura ambiente. Los alcoholes con moléculas más grandes pueden ser sólidos blanquecinos.
Punto de ebullición
Los alcoholes tienen puntos de ebullición altos debido a:
- El grupo hidroxilo, que permite los enlaces de hidrógeno.
- La cadena de carbonos, que tiene fuerzas de van der Waals (fuerzas de atracción entre moléculas).
El punto de ebullición de un alcohol es más alto si:
- Tiene más grupos alcohol: un diol (con dos grupos -OH) hierve a una temperatura más alta que un alcohol simple de tamaño similar.
- La cadena de carbonos es más larga: por ejemplo, el metanol hierve a 65 °C, el etanol a 78 °C, y el hexan-1-ol a 157 °C.
- La cadena de carbonos es lineal (sin ramificaciones), lo que permite más fuerzas de van der Waals.
Solubilidad
La capacidad de los alcoholes para mezclarse con el agua depende de dos factores opuestos:
- La cadena de carbonos, que no se mezcla bien con el agua (es hidrófoba).
- El grupo hidroxilo, que sí se mezcla bien con el agua (es hidrófilo) gracias a los enlaces de hidrógeno.
Por lo tanto, los alcoholes se mezclan mejor con el agua si:
- La cadena de carbonos es más corta: el metanol, etanol y propanoles se mezclan completamente con el agua. Los alcoholes más grandes son casi insolubles.
- Tienen más grupos alcohol: por ejemplo, los butanodioles se mezclan completamente con el agua, mientras que el butan-1-ol no tanto.
- La cadena de carbonos está ramificada: las ramificaciones hacen que la molécula sea más compacta y se mezcle mejor con el agua.
Los alcoholes con moléculas pequeñas generalmente se mezclan bien con otros disolventes orgánicos como la acetona o el éter.
Propiedades químicas de los alcoholes
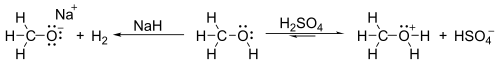 Los alcoholes pueden actuar como ácidos o como bases porque su grupo hidroxilo es similar al agua.
Los alcoholes pueden actuar como ácidos o como bases porque su grupo hidroxilo es similar al agua.
Si un alcohol reacciona con una base fuerte, el grupo hidroxilo pierde un protón, dejando el oxígeno con una carga negativa. La acidez de este grupo depende de qué tan "ocupado" esté el carbono al que se une (impedimento estérico) y de los átomos cercanos (efecto inductivo). Un alcohol con el grupo hidroxilo en un carbono terciario es menos ácido que uno en un carbono secundario, y este menos que uno en un carbono primario. Si la molécula tiene átomos muy electronegativos cerca, la acidez aumenta.
Por otro lado, el oxígeno del grupo hidroxilo tiene pares de electrones libres, lo que le permite aceptar un protón y actuar como una base. Sin embargo, esto solo ocurre con ácidos muy fuertes.
Reacciones de halogenación de alcoholes
La halogenación es cuando se reemplaza el grupo hidroxilo (-OH) de un alcohol por un átomo de halógeno (como flúor, cloro, bromo o yodo).
- Para añadir flúor, se usan reactivos especiales como el reactivo de Olah o el de Ishikawa.
- Para añadir cloro, la velocidad de reacción depende del tipo de alcohol:
* Los alcoholes primarios reaccionan muy lentamente. * Los alcoholes secundarios tardan entre 5 y 20 minutos. * Los alcoholes terciarios reaccionan casi al instante. Los alcoholes terciarios reaccionan directamente con ácido clorhídrico. Para alcoholes primarios o secundarios, se necesita un "activador" como el cloruro de zinc. También se puede usar cloruro de tionilo (SOCl2).
Ejemplos:
- (H3C)3C-OH + HCl → (H3C)3C-Cl + H2O
- CH3-(CH2)6-OH + SOCl2 → CH3-(CH2)6-Cl + SO2 + HCl
Para añadir bromo, se usa ácido bromhídrico o tribromuro de fósforo (PBr3). Para añadir yodo, se usa fósforo rojo y yodo para formar triyoduro de fósforo en el momento.
Oxidación de alcoholes
La oxidación es una reacción química donde un alcohol pierde electrones.
- Metanol: Puede oxidarse a formaldehído o ácido fórmico usando métodos como la reacción de Adkins-Peterson.
- Alcohol primario: Puede oxidarse a un aldehído o a un ácido carboxílico, dependiendo del agente oxidante.
- Alcohol secundario: Se oxidan para formar cetonas.
- Alcohol terciario: Son más difíciles de oxidar. Si se usa un oxidante muy fuerte como el permanganato de potasio, se rompe la molécula, formando una cetona más pequeña y liberando metano.
Deshidratación de alcoholes
La deshidratación de alcoholes es un proceso químico que convierte un alcohol en un alqueno (un compuesto con un doble enlace carbono-carbono). Para esto, se usa un ácido mineral (como el ácido sulfúrico) que ayuda a eliminar el grupo hidroxilo (-OH) del alcohol, formando un doble enlace en su lugar y liberando agua.
Esta reacción es muy útil porque permite transformar fácilmente un alcohol en un alqueno. Un ejemplo es la creación de ciclohexeno a partir de ciclohexanol. Si se necesitan condiciones más suaves, se puede usar el reactivo de Burgess.
¿De dónde se obtienen los alcoholes?
Muchos alcoholes pueden producirse por fermentación de frutas o granos con levadura. Sin embargo, solo el etanol se produce comercialmente de esta manera, principalmente para usarlo como combustible. Otros alcoholes se obtienen generalmente de forma sintética a partir del gas natural o del petróleo.
Usos de los alcoholes
Los alcoholes tienen muchos usos en la industria y en la ciencia. Se utilizan como disolventes (sustancias que disuelven otras) y como combustibles. El etanol y el metanol pueden quemarse de forma más limpia que la gasolina o el gasoil.
Debido a que no son muy tóxicos y pueden disolver sustancias que no se mezclan con agua, el etanol se usa a menudo como disolvente en productos farmacéuticos, perfumes y esencias como la vainilla. Los alcoholes también son intermediarios muy versátiles en la síntesis orgánica, lo que significa que se usan para crear muchas otras sustancias químicas.
El alcohol isopropílico (o 2-propanol) es muy importante en la industria porque es un excelente disolvente orgánico. Se usa para tratar resinas, gomas y lacas, y en la fabricación de acetona.
Alcohol de botiquín
El alcohol de botiquín, que se usa para desinfectar, puede tener diferentes composiciones. A menudo es alcohol etílico al 96% con algunos aditivos, como el cloruro de benzalconio o sustancias que le dan un sabor desagradable. Esto se conoce como alcohol etílico desnaturalizado. A veces se usan otros desnaturalizantes como el ftalato de dietilo y el metanol, lo que hace que algunos alcoholes desnaturalizados sean tóxicos si se ingieren.
También puede contener alcohol isopropílico, que no es apto para beber, pero es muy efectivo como secante o desinfectante.
Véase también
- Anexo:Alcoholes
- Éster
- Enlace carbono-carbono