Molibdeno para niños
Datos para niños Niobio ← Molibdeno → Tecnecio |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Molibdeno, Mo, 42 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Metales de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 6, 5, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 95,94 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Kr] 4d5 5s1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Mohs | 5,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 13, 1 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Gris metálico | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 145 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 2,16 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 190 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 154 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 2,3,4,5,6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óxido | Ácido fuerte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 684,3 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 1560 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª energía de ionización | 2618 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª energía de ionización | 4480 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 10280 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 2896 K (2623 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 4912 K (4639 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 598 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 32 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 3,47 Pa a 3000 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Cúbica centrada en el cuerpo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 250 J/(kg·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | 18,7·106 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 139 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del molibdeno | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El molibdeno es un elemento químico con el número atómico 42. Se encuentra en el grupo 6 de la tabla periódica de los elementos y su símbolo es Mo.
Es un metal muy importante para la vida y se usa mucho en aceros aleados. El molibdeno es de color plateado y es uno de los elementos con el punto de fusión más alto.
No se encuentra como metal puro en la naturaleza. En la industria, los compuestos de molibdeno se usan en lugares con mucha presión y calor. También se emplean como pigmentos y para ayudar en reacciones químicas.
La mayoría de los compuestos de molibdeno no se disuelven bien en agua. Sin embargo, el ion molibdato (MoO4-2) sí es soluble. Este ion se forma cuando los minerales de molibdeno entran en contacto con el oxígeno y el agua.
Se cree que la presencia de molibdeno soluble en los océanos antiguos fue clave para el desarrollo de la vida. Esto se debe a que las enzimas que contienen molibdeno ayudaron a algunas bacterias a usar el nitrógeno del aire. Esto, a su vez, permitió que los océanos fueran más fértiles y que se desarrollaran organismos más complejos.
Existen al menos 50 enzimas con molibdeno en bacterias y animales. Aunque solo las enzimas de bacterias y cianobacterias ayudan a fijar el nitrógeno. El molibdeno es necesario para la vida de organismos más grandes, pero no para todas las bacterias.
Contenido
Molibdeno: Un Elemento Sorprendente
¿Cómo se ve y qué propiedades tiene?
El molibdeno es un metal de transición de color blanco plateado y muy duro. Tiene uno de los puntos de fusión más altos de todos los elementos. Esto significa que necesita muchísimo calor para derretirse.
Se usa en pequeñas cantidades para hacer aceros más duros y resistentes a la corrosión. Es el único metal de su grupo en la tabla periódica que es esencial para la vida. Lo encontramos en algunas enzimas que ayudan a transferir electrones o a fijar el nitrógeno.
El molibdeno es uno de los pocos metales que resiste bien el ácido clorhídrico. Incluso un pequeño porcentaje de molibdeno (alrededor del 2%) puede hacer que los aceros sean mucho más resistentes. Esto es útil en ambientes marinos o donde hay compuestos de cloro.
En su forma pura, el molibdeno tiene una dureza de Mohs de 5,5. Su punto de fusión es de 2623 °C. Solo algunos elementos como el tántalo, osmio, renio, wolframio y carbono tienen puntos de fusión más altos. El molibdeno solo se oxida rápidamente a temperaturas muy altas, por encima de 600 °C.
¿Cómo se comporta químicamente?
El molibdeno es un metal de transición que no reacciona con el oxígeno o el agua a temperatura ambiente. Pero si se calienta mucho, forma óxido de molibdeno (VI).
El molibdeno puede tener varios estados de oxidación. El más común es el molibdeno (VI), que se encuentra en el óxido de molibdeno (MoO3). Otro compuesto importante es el disulfuro de molibdeno (MoS2).
El óxido de molibdeno (VI) se disuelve en bases y forma molibdatos. Estos molibdatos pueden unirse con otros iones para crear estructuras complejas. Por ejemplo, un compuesto de molibdeno y fósforo se usa para detectar fósforo en pruebas de espectroscopia.
El molibdeno también puede formar diferentes tipos de cloruros, como el Cloruro de molibdeno (II) (amarillo) o el Cloruro de molibdeno (VI) (marrón).
Usos del Molibdeno
El molibdeno tiene muchas aplicaciones importantes:
- Aleaciones de Acero: Cerca de dos tercios del molibdeno se usan en aleaciones. Se hizo muy popular durante la Primera Guerra Mundial para crear aceros muy resistentes al calor y la corrosión. Estos aceros se usan en la construcción, aviones y automóviles.
- Catalizador en la Industria Petrolera: Ayuda a eliminar el azufre del petróleo. También es clave en catalizadores para producir ácido acrílico.
- Medicina Nuclear: El isótopo 99Mo se usa para producir radiofármacos en medicina nuclear.
- Pigmentos: Se usa para crear pigmentos de color anaranjado en pinturas, tintes, plásticos y caucho.
- Lubricantes: El disulfuro de molibdeno (MoS2) es un excelente lubricante. Forma una capa protectora en las superficies metálicas, reduciendo el desgaste y funcionando bien a altas temperaturas.
- Electrónica: Se emplea en capas conductoras de metal en transistores especiales (TFT).
Historia del Molibdeno
El molibdeno no se encuentra puro en la naturaleza. Sus compuestos fueron confundidos con otros elementos, como el plomo, hasta el siglo XVIII.
En 1778, Carl Wilhelm Scheele descubrió que el mineral molibdenita (MoS2) contenía un nuevo elemento. Lo llamó "acidum molibdenae", que significa "ácido como el plomo", por la confusión inicial. En 1782, Peter Jacob Hjelm logró aislar el metal, aunque no era completamente puro.
Durante mucho tiempo, el molibdeno se usó muy poco. Pero a finales del siglo XIX, una empresa descubrió que al añadirlo a las aleaciones, estas mejoraban mucho.
En la Primera Guerra Mundial, la compañía francesa Schneider Electric fabricó las primeras armaduras de acero con molibdeno. Los tanques británicos, que inicialmente usaban planchas de manganeso ineficaces, las reemplazaron con planchas de molibdeno de 25 mm. Esto hizo que los tanques fueran más rápidos y fáciles de maniobrar. La gran demanda de molibdeno durante las guerras mundiales influyó mucho en su precio y producción.
¿Dónde se encuentra y cómo se obtiene?
La principal fuente de molibdeno es el mineral molibdenita (MoS2). También se encuentra en otros minerales como la wulfenita y la powellita.
El molibdeno se obtiene directamente de sus minas o como un subproducto de la minería del cobre. De hecho, la minería del cobre es la forma más común de obtenerlo, ya que el molibdeno está presente en estas minas en pequeñas cantidades (entre 0,01% y 0,5%).
Aproximadamente la mitad de la producción mundial de molibdeno proviene de Estados Unidos. Otros grandes productores son China, Chile, Perú y Canadá. La mina Knaben en Noruega fue la primera mina de molibdeno, abierta en 1885.
El molibdeno es el 54.º elemento más común en la corteza terrestre y el 25.º más común en los océanos.
Para obtener molibdeno, la molibdenita se calienta a 700 °C. El sulfuro se convierte en óxido de molibdeno (VI) al reaccionar con el aire. Luego, este óxido se calienta a 1100 °C para purificarlo.
El molibdeno puro se produce reduciendo el óxido con hidrógeno. Si se va a usar para hacer acero, se mezcla con hierro para producir ferromolibdeno, que suele contener un 60% de molibdeno.
El precio del molibdeno ha variado mucho. En 2009, valía unos $30,000 por tonelada. En 2005, llegó a un máximo de $103,000 por tonelada debido a la alta demanda.
| 1. | 130.000 | |
| 2. | 56.000 | |
| 3. | 43.600 | |
| 4. | 30.400 | |
| 5. | 16.600 | |
| 6. | 5.000 | |
| 7. | 3.900 | |
| 8. | 3.500 | |
| 9. | 2.800 | |
| 10. | 1.800 |
Fuente: USGS.
El Molibdeno en los Seres Vivos
El molibdeno es un elemento esencial para la vida. Se encuentra en pequeñas cantidades en la naturaleza y en el agua de mar. Los seres vivos pueden absorberlo fácilmente.
El molibdeno forma parte de un componente llamado cofactor de molibdeno (coMo). Este cofactor se encuentra en varias enzimas que ayudan a transferir átomos de oxígeno y electrones. Algunas de estas enzimas son importantes para el ciclo del nitrógeno en las plantas y para procesos en el hígado de los animales.
¿Cómo funciona en nuestro cuerpo?
En los seres vivos, el molibdeno es un metal clave en el centro de algunas enzimas. Por ejemplo, en ciertas bacterias, la enzima nitrogenasa usa molibdeno para transformar el nitrógeno del aire en una forma que las plantas pueden usar.
Se cree que la escasez de molibdeno en los océanos de la Tierra primitiva pudo haber limitado la evolución de la vida compleja. Esto se debe a que los organismos más grandes no pueden fijar el nitrógeno por sí mismos y dependen de las bacterias.
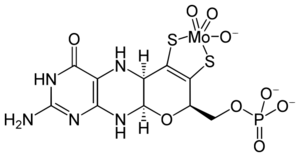
El molibdeno se transporta en el cuerpo humano como molibdato. Se conocen al menos 50 enzimas que contienen molibdeno, principalmente en bacterias. En animales y humanos, estas enzimas ayudan en procesos importantes como la descomposición de ciertas sustancias. La cantidad de molibdeno en el cuerpo afecta la actividad de estas enzimas. También influye en la síntesis de proteínas, el metabolismo y el crecimiento.
Molibdeno en la dieta humana
El cuerpo humano contiene aproximadamente 0,07 mg de molibdeno por kilogramo de peso. Se encuentra en altas concentraciones en el hígado, los riñones y las vértebras. También está presente en el esmalte de los dientes y puede ayudar a prevenir su deterioro.
Alimentos como la carne de cerdo, cordero, hígado de res, judías verdes, huevos, semillas de girasol, harina de trigo, lentejas y cereales son buenas fuentes de molibdeno.
La cantidad diaria promedio de molibdeno que una persona ingiere varía entre 0,12 y 0,24 mg. No se han observado problemas graves por una alta ingesta de molibdeno en humanos. Sin embargo, estudios en animales sugieren que consumir más de 10 mg al día por mucho tiempo podría causar diarrea, retraso en el crecimiento y bajo peso al nacer. También podría afectar los pulmones, riñones y el hígado.
La falta de molibdeno en la dieta, debido a su baja concentración en el suelo, se ha relacionado con un mayor riesgo de un tipo de cáncer de esófago en algunas partes de China e Irán.
Molibdeno y el Cobre
Altos niveles de molibdeno pueden dificultar que el cuerpo absorba cobre, lo que puede llevar a una deficiencia de cobre. El molibdeno impide que las proteínas de la sangre se unan al cobre y aumenta la cantidad de cobre que se elimina por la orina.
En animales como los rumiantes, consumir mucho molibdeno puede causar diarrea, pérdida de peso, anemia y pérdida de color en el pelo. Estos problemas pueden mejorar si se les da más cobre.
Un compuesto llamado tetratiomolibdato de amonio se usa para reducir el cobre en el cuerpo. Se ha utilizado para tratar una enfermedad hereditaria que afecta el metabolismo del cobre en humanos, llamada enfermedad de Wilson. Este compuesto ayuda a que el cuerpo absorba menos cobre y a que lo elimine más. También se está investigando su uso en el tratamiento de algunas enfermedades que causan un crecimiento excesivo de vasos sanguíneos, como ciertos tipos de cáncer.
Isótopos del Molibdeno
El molibdeno tiene seis isótopos estables y muchos radioisótopos. La mayoría de estos radioisótopos tienen una vida muy corta.
El isótopo 99Mo es muy importante en la industria nuclear. Se usa para producir 99mTc, un radiofármaco que se utiliza mucho en medicina nuclear para realizar diagnósticos.
Se conocen 35 isótopos de molibdeno. Siete de ellos se encuentran de forma natural, pero solo el molibdeno-92 y el molibdeno-100 son inestables. El molibdeno-98 es el isótopo más común.
Precauciones con el Molibdeno
El polvo y el humo que se producen al extraer o trabajar con molibdeno pueden ser perjudiciales si se inhalan o ingieren. La exposición prolongada a niveles bajos puede irritar los ojos y la piel. Es importante evitar la inhalación o ingestión directa de molibdeno y sus óxidos.
La OSHA establece un límite máximo de exposición al molibdeno en el aire de 5 mg por metro cúbico durante una jornada de 8 horas. La exposición continua a niveles más altos (entre 60 y 600 mg por metro cúbico) puede causar síntomas como cansancio, dolores de cabeza y dolores en las articulaciones.
Véase también
 En inglés: Molybdenum Facts for Kids
En inglés: Molybdenum Facts for Kids



