Ion para niños

Un ion es una partícula con carga eléctrica. Puede ser un átomo o una molécula que ya no es eléctricamente neutra. Esto ocurre cuando un átomo o molécula gana o pierde electrones. Este proceso se llama ionización.
Los electrones tienen una carga negativa. Si un átomo neutro gana uno o más electrones, se convierte en un ion con carga negativa. Si pierde electrones, se convierte en un ion con carga positiva. Es importante recordar que el número de protones en el núcleo del átomo no cambia cuando se forma un ion.
Contenido
¿Qué son los aniones y los cationes?
Los iones se clasifican según su carga eléctrica:
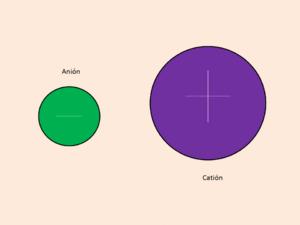
- Los aniones son iones con carga negativa. Tienen más electrones que protones. La palabra "anión" viene del griego y significa "el que va hacia arriba".
- Los cationes son iones con carga positiva. Tienen menos electrones que protones. La palabra "catión" también viene del griego y significa "el que va hacia abajo".
Los aniones son atraídos por el ánodo (el polo positivo en un circuito eléctrico), mientras que los cationes son atraídos por el cátodo (el polo negativo).
Iones monoatómicos y poliatómicos
Un ion puede estar formado por un solo átomo, y en ese caso se llama ion monoatómico. Por ejemplo, el ion sodio (Na+) o el ion cloruro (Cl-).
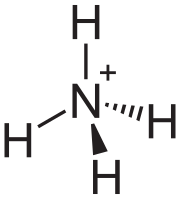
Si un ion está formado por dos o más átomos unidos, se llama ion poliatómico. Un ejemplo es el ion amonio (NH4+), que tiene un átomo de nitrógeno y cuatro de hidrógeno.
Energía de ionización: ¿Cuánto cuesta quitar un electrón?
La energía de ionización es la cantidad de energía que se necesita para quitar el electrón más externo de un átomo neutro que está en estado gaseoso.
Por ejemplo, para quitar el primer electrón de un átomo X, se necesita la primera energía de ionización: X + 1.ª energía de ionización → X+ + e-
Si queremos quitar un segundo electrón de ese ion X+, necesitaremos la segunda energía de ionización, y así sucesivamente: X+ + 2.ª energía de ionización → X2+ + e-
Esta energía se mide en unidades como el electrón-voltio (eV) o kilojulios por mol (kJ/mol).
Tendencias de la energía de ionización
- En un mismo grupo (columna) de la tabla periódica: La energía de ionización disminuye a medida que bajamos en el grupo. Esto ocurre porque los electrones más externos están cada vez más lejos del núcleo y son menos atraídos por él. Además, los electrones de las capas interiores "protegen" a los externos de la atracción del núcleo, haciendo más fácil quitarlos.
- En un mismo período (fila) de la tabla periódica: La energía de ionización generalmente aumenta de izquierda a derecha. Esto se debe a que, aunque los electrones están en el mismo nivel de energía, la carga positiva del núcleo aumenta, atrayendo con más fuerza a los electrones.
Los gases nobles (como el helio o el neón) tienen las energías de ionización más altas. Esto es porque su configuración de electrones es muy estable, y se necesita mucha energía para quitarles un electrón.
Tipos de iones
Además de los aniones y cationes, existen otros tipos de iones:
- Un dianión es un ion que tiene dos cargas negativas.
- Un zwitterión es un ion que, aunque tiene cargas positivas y negativas en diferentes partes de su estructura, su carga neta total es cero.
- Los radicales iónicos son iones que tienen un número impar de electrones, lo que los hace muy inestables y reactivos.
Plasma: El cuarto estado de la materia
El plasma es un estado de la materia donde un gas está lleno de iones. Es como un gas, pero con una gran cantidad de partículas cargadas. Se le considera el cuarto estado de la materia, después del sólido, líquido y gaseoso, porque sus propiedades son muy diferentes. La mayor parte del universo visible, como las estrellas, está formada por plasma.
Usos y aplicaciones de los iones
Los iones son muy importantes en nuestra vida diaria y en la naturaleza:
- En los seres vivos: Iones como el sodio, el potasio y el calcio son esenciales para el funcionamiento de las células en todos los organismos vivos. Ayudan a transmitir señales y a mantener el equilibrio.
- En la tecnología: Los iones se usan en muchas aplicaciones, desde detectores de humo hasta motores iónicos que se utilizan en naves espaciales.
- En el agua: La cantidad de iones disueltos en el agua nos indica su calidad.
Iones comunes
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Véase también
 En inglés: Ion Facts for Kids
En inglés: Ion Facts for Kids
- Enlace iónico
- Electronegatividad
- Fusión nuclear
- Ionización
- Potencial de reducción