Curio para niños
Datos para niños Americio ← Curio → Berkelio |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Curio, Cm, 96 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Actínidos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| , período, bloque | , 7, f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 247 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Rn] 5f7 6d1 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 32, 25, 9, 2 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Plateado | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,3 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 581 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 13.510 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 1613 K (1340 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 3383 K (3110 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 15 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
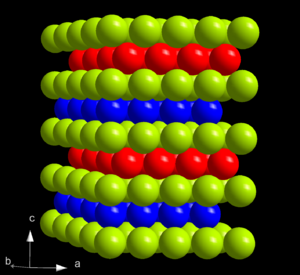
| Estructura cristalina | Hexagonal compacta | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del curio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El curio es un elemento sintético de la tabla periódica. Su símbolo es Cm y su número atómico es 96. No se encuentra en la naturaleza. Se crea en laboratorios bombardeando plutonio con partículas alfa. Es parte de la serie de los actínidos.
El curio es un metal plateado, duro y denso. Tiene puntos de fusión y ebullición altos para un actínido. Aunque normalmente es paramagnético, se vuelve antiferromagnético cuando se enfría. En sus compuestos, el curio suele tener una valencia de +3, aunque a veces puede ser +4. Se oxida fácilmente, formando óxidos.
El curio puede formar compuestos que brillan intensamente bajo luz ultravioleta (fluorescencia). Sin embargo, es importante saber que el curio es radiactivo. Si entra en el cuerpo humano, puede acumularse en los huesos, pulmones e hígado, lo que puede causar problemas de salud graves.
El curio metálico se puede obtener al reducir el trifluoruro de curio con vapor de bario. El metal tiene un brillo plateado que se pierde al contacto con el aire. Se disuelve fácilmente en ácidos comunes, formando un ion con carga positiva.
Se han estudiado varios compuestos sólidos de curio. Sus estructuras se han determinado usando rayos X. Algunos ejemplos son CmF4, CmF3, CmCl3, CmBr3, CmI3, Cm2O3 y CmO2.
Contenido
Historia del Curio

El curio fue creado por primera vez en 1944. Esto ocurrió en la Universidad de California, Berkeley. Los científicos que lo lograron fueron Glenn T. Seaborg, Ralph A. James y Albert Ghiorso.
El nombre "curio" se eligió para honrar a Marie Curie y a su esposo Pierre. Ellos fueron científicos muy importantes. Son famosos por descubrir el radio y por sus grandes aportaciones al estudio de la radiactividad.
¿Cómo es el Curio?
Propiedades Físicas del Curio

El curio es un elemento radiactivo creado por el ser humano. Es un metal duro y denso. Su apariencia es de color blanco plateado. Sus características físicas y químicas son parecidas a las del gadolinio.
El curio tiene un punto de fusión de 1344 °C. Esto es mucho más alto que el de otros elementos similares como el neptunio (637 °C) o el plutonio (639 °C). El gadolinio, por ejemplo, se funde a 1312 °C. El punto de ebullición del curio es de 3556 °C.
Con una densidad de 13.52 g/cm3, el curio es más ligero que el neptunio y el plutonio. Sin embargo, es más pesado que muchos otros metales.
El curio puede existir en dos formas cristalinas. La forma alfa (α-Cm) es la más estable en condiciones normales. Tiene una estructura hexagonal. A presiones muy altas, el α-Cm se transforma en β-Cm, que tiene una estructura cúbica. Si se comprime aún más, el curio puede adoptar una tercera estructura.
El curio tiene propiedades magnéticas especiales. A diferencia del americio, el curio se vuelve antiferromagnético cuando se enfría a temperaturas muy bajas. Algunos de sus compuestos también muestran propiedades magnéticas al enfriarse.
La resistividad eléctrica del curio aumenta con la temperatura. Esto significa que le cuesta más conducir la electricidad a temperaturas más altas. La radiación que emite el propio curio puede dañar su estructura. Esto hace que su resistividad cambie con el tiempo.
Bajo luz ultravioleta, los iones de curio(III) brillan con una luz amarilla-anaranjada muy fuerte. Este brillo se llama fluorescencia. Estudiar esta fluorescencia ayuda a entender cómo interactúan los iones de curio con otras sustancias.
Propiedades Químicas del Curio
En soluciones, los iones de curio suelen tener un estado de oxidación de +3. Este es el estado más estable. El estado de oxidación +4 se ve en algunos compuestos sólidos, como el CmO2.
El curio en solución acuosa es de incoloro a verde claro. El ion Cm4+ es de color amarillo claro. El curio se comporta de forma similar al americio y a muchos lantánidos en sus reacciones químicas.
Los iones de curio son "ácidos de Lewis fuertes". Esto significa que forman uniones muy estables con otras sustancias. En sus compuestos, el curio a menudo se rodea de 9 átomos o grupos de átomos.
Usos del Curio
Radionucleidos y Energía
El curio es uno de los elementos más radiactivos que se pueden aislar. Sus isótopos más comunes, el curio-242 y el curio-244, emiten partículas alfa muy potentes. Tienen vidas medias relativamente cortas. Por ejemplo, el curio-242 dura unos 162.8 días y el curio-244, 18.1 años.
Estos isótopos generan mucho calor. Por eso, el curio se podría usar en generadores termoeléctricos radioactivos. Estos generadores convierten el calor de la radiactividad en electricidad. Se usan en naves espaciales. Sin embargo, el curio-244 produce muchos neutrones y rayos gamma. Esto requiere un blindaje muy grueso para proteger de la radiación, lo que lo hace poco práctico.
Un uso más prometedor del curio-242 es para producir plutonio-238. Este isótopo de plutonio es ideal para generadores termoeléctricos más pequeños, como los que se usan en marcapasos cardíacos.
El curio también se usa para crear otros elementos muy pesados. Por ejemplo, al bombardear curio-248 con otros elementos, se han producido isótopos de seaborgio, hasio y livermorio. El californio fue descubierto al irradiar curio-242 con partículas alfa.
Algunos isótopos de curio, como el curio-243, curio-245 y curio-247, son muy fáciles de fisionar. Esto significa que sus núcleos se pueden dividir para liberar energía. Por ello, podrían usarse para generar energía adicional en reactores nucleares. Esto también ayuda a reducir lo dañino que puede ser el combustible nuclear usado a largo plazo. El isótopo más estable del curio es el curio-247, con una vida media de unos 15.6 millones de años.
Espectrómetro de Rayos X

El uso más práctico del curio-244 es como fuente de partículas alfa en los espectrómetros de rayos X mediante partículas alfa (APXS). Estos instrumentos se han usado en misiones espaciales. Por ejemplo, en los robots que exploraron Marte, como el Sojourner y los Mars Exploration Rovers. También se usaron en la sonda Philae y en el Mars Science Laboratory. Su objetivo es analizar la composición de las rocas en la superficie de Marte.
Los APXS usan pequeñas fuentes de curio. Estas fuentes emiten partículas alfa que chocan con la muestra. Al analizar las partículas que rebotan, los científicos pueden saber de qué elementos están hechas las rocas. Esto ayuda a entender la composición de los planetas.
Véase también
 En inglés: Curium Facts for Kids
En inglés: Curium Facts for Kids