Mercurio (elemento) para niños
Datos para niños Oro ← Mercurio → Talio |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Mercurio, Hg, 80 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Metales de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 12, 6, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 200,59 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Xe] 4f14 5d10 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Mohs | 1,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 32, 18, 2 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Blanco plateado. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 150 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 2,00 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 171 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 149 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de van der Waals | 155 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 4, 2, 1 (levemente básico) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 1007,1 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 1810 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª energía de ionización | 3300 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Líquido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 13534 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 234,32 K (−39 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 629,88 K (357 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 59,229 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 2,295 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 0,0002 Pa a 234 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Romboédrica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 140 J/(kg·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 8,34 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 1407 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del mercurio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El mercurio es un elemento químico con el símbolo Hg y número atómico 80. En el pasado, se le conocía como plata líquida o azogue. Es un metal pesado de color plateado. El mercurio es el único metal que se encuentra en estado líquido a temperatura ambiente normal. Otro elemento que es líquido en estas condiciones es el bromo, que no es un metal. Algunos otros metales, como el cesio, el galio y el rubidio, se derriten a temperaturas un poco más altas.
El mercurio se encuentra en la naturaleza en diferentes lugares del mundo. Su forma más común es el cinabrio, que es un sulfuro de mercurio. El pigmento rojo brillante llamado bermellón se hace moliendo cinabrio natural o sulfuro de mercurio creado en laboratorios.
El mercurio se ha usado en termómetros, barómetros y otros instrumentos de medición. Sin embargo, debido a que puede ser dañino, muchos de estos aparatos ahora usan otras sustancias. Por ejemplo, los termómetros de vidrio pueden usar alcohol o galinstano. El mercurio todavía se usa en algunas amalgamas dentales en ciertos países y en lámparas fluorescentes. En estas lámparas, la electricidad pasa a través de vapor de mercurio, creando radiación ultravioleta que hace que un recubrimiento especial brille y produzca luz visible.
Estar expuesto al mercurio puede ser peligroso. Esto puede ocurrir al respirar su vapor o al ingerir algunas de sus formas.
Contenido
¿Qué es el Mercurio?
El mercurio es un metal pesado de color plateado. A temperatura ambiente, es un líquido sin olor. No es muy bueno para conducir el calor en comparación con otros metales, pero sí es un buen conductor de la electricidad.
Se mezcla fácilmente con muchos otros metales, como el oro o la plata, para formar amalgamas. Sin embargo, no se mezcla con el hierro. No se disuelve en agua, pero sí en ácido nítrico.
Cuando el mercurio se calienta por encima de los 40 °C, produce vapores que pueden ser dañinos. Estos vapores son más pesados que el aire. Es importante tener cuidado con el mercurio, ya que puede ser perjudicial si se inhala, se ingiere o si entra en contacto con la piel o los ojos.
Propiedades Físicas del Mercurio

El mercurio es un metal pesado y brillante. Tiene un punto de solidificación muy bajo, de -38.83 °C, y un punto de ebullición de 356.73 °C. Estas temperaturas son muy bajas para un metal.
Cuando el mercurio se congela, su volumen se reduce en un 3.59%. Su densidad cambia de 13.69 g/cm³ en estado líquido a 14.184 g/cm³ cuando se vuelve sólido.
Propiedades Químicas del Mercurio
El mercurio no reacciona con la mayoría de los ácidos suaves. Sin embargo, los ácidos más fuertes, como el ácido sulfúrico concentrado o el ácido nítrico, sí lo disuelven. El mercurio también reacciona con el ácido sulfhídrico que se encuentra en el aire. Además, se combina con el azufre sólido, por eso el azufre se usa para limpiar derrames de mercurio.
¿Qué son las Amalgamas de Mercurio?
El mercurio puede disolver muchos metales, como el oro y la plata, para formar amalgamas. El hierro es una excepción, por eso se usaban recipientes de hierro para guardar mercurio.
Cuando el mercurio entra en contacto con el aluminio puro, forma una "amalgama de aluminio". Esta amalgama daña la capa protectora de óxido de aluminio que normalmente evita que el aluminio se oxide. Incluso una pequeña cantidad de mercurio puede corroer gravemente el aluminio. Por esta razón, el mercurio no está permitido en aviones, ya que podría dañar las partes de aluminio.
Isótopos del Mercurio
El mercurio tiene siete isotopos estables. El más común es el 202
Hg, que representa casi el 30% del mercurio natural. También existen radioisótopos, que son formas inestables del elemento. Los más duraderos son el 194
Hg, que tiene una vida media de 444 años, y el 203
Hg, con una vida media de 46.612 días.
¿De Dónde Viene la Palabra Mercurio?
El símbolo químico del mercurio, Hg, viene de la palabra griega hydrargyros, que significa "agua-plata". Esto se debe a que el mercurio es líquido como el agua y brillante como la plata.
El nombre "Mercurio" también se relaciona con el dios romano Mercurio, conocido por ser rápido y ágil. Por la misma razón, se asocia con el planeta Mercurio. El símbolo del planeta también era el símbolo alquímico del metal.
Historia del Mercurio
El mercurio se ha usado desde hace mucho tiempo. Se ha encontrado en tumbas del Antiguo Egipto que datan del año 1500 a.C.
En China y el Tíbet, se creía que el mercurio podía alargar la vida y mejorar la salud. Sin embargo, ahora sabemos que la exposición al mercurio es muy peligrosa. Por ejemplo, se dice que el primer emperador de China, Qin Shi Huang, murió por beber una mezcla de mercurio y jade, buscando la vida eterna.
En la Antigua Grecia, el mercurio se usaba en ungüentos. En Egipto y Roma, se usaba en cosméticos. Los alquimistas pensaban que el mercurio era la base de todos los metales y lo usaban en sus intentos de convertir metales comunes en oro.
Las minas de Almadén (España), monte Amiata (Italia) e Idrija (Eslovenia) fueron muy importantes en la producción de mercurio durante siglos.
¿Dónde se Encuentra el Mercurio?
El mercurio es un elemento poco común en la corteza terrestre. Se encuentra principalmente como cinabrio (HgS), que es el mineral más abundante. Los depósitos de mercurio suelen estar en zonas donde la Tierra ha tenido mucha actividad geológica, como cerca de volcanes.
Desde el año 1558, el mercurio fue muy importante para extraer plata de sus minerales, especialmente en las colonias españolas en América. Las minas de Almadén en España y Huancavelica en Perú fueron grandes productoras de mercurio.
Hoy en día, muchas minas antiguas de mercurio han cerrado debido a la disminución de su precio y a las preocupaciones por su impacto ambiental. La última mina de mercurio en Estados Unidos, McDermitt en Nevada, cerró en 1992.
El mercurio se obtiene calentando el cinabrio en presencia de aire y luego enfriando el vapor. La reacción es:
- HgS + O2 → Hg + SO2
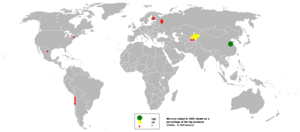
En 2005, China fue el mayor productor de mercurio, con casi dos tercios de la producción mundial.
Debido a lo dañino que es el mercurio, tanto su extracción como su refinado son actividades peligrosas. La salud de los mineros siempre ha estado en riesgo.
Producción Mundial de Mercurio
| N.º | País | Producción | (Tm) |
|---|---|---|---|
| 1 |
|
1600 | |
| 2 |
|
100 | |
| 3 |
|
50 | |
| 4 |
|
50 | |
| 5 |
|
45 | |
| 6 |
|
45 | |
| 7 |
|
32 | |
| (Año 2013. Fuente:IndexMundi) | |||
La producción mundial de mercurio creció mucho en el pasado, especialmente por la minería de oro y plata. Sin embargo, a partir de los años 80, empezó a disminuir debido a los riesgos ambientales.
Actualmente, China domina el mercado mundial, produciendo más del 80% del mercurio. En 2013, la producción mundial fue de unas 1900 toneladas, mucho menos que en su punto máximo en los años 70.
| 1. | 3.600 | |
| 2. | 100 | |
| 3. | 63 | |
| 4. | 50 | |
| 5. | 40 | |
| 6. | 20 | |
| 7. | 15 |
Fuente: USGS.
Usos del Mercurio
El mercurio se usa principalmente para fabricar productos químicos industriales y en aparatos eléctricos. También se emplea en algunos termómetros, sobre todo para medir altas temperaturas. Cada vez se usa más en lámparas fluorescentes. Muchas de sus otras aplicaciones están siendo eliminadas por razones de seguridad y salud, siendo reemplazado por materiales menos dañinos.
Usos en Medicina
El mercurio y sus compuestos se han usado en medicina, pero hoy en día son mucho menos comunes. Esto se debe a que se conocen mejor los efectos dañinos del mercurio.
El mercurio es un ingrediente en las amalgamas dentales, que se usan para rellenar caries. El Thiomersal es un compuesto de mercurio que se usaba como conservante en algunas vacunas. Aunque se ha debatido sobre su seguridad, los estudios científicos no han encontrado pruebas de que cause problemas de salud graves en niños. Sin embargo, se ha reducido o eliminado de la mayoría de las vacunas infantiles en Estados Unidos.
Otro compuesto de mercurio, la merbromina (conocida como mercurocromo), es un antiséptico que se usa para pequeñas heridas en algunos países.
En la medicina china tradicional, el cinabrio (un mineral de mercurio) se ha usado en algunas medicinas. Sin embargo, se ha descubierto que puede causar problemas de salud si se calienta, se toma en exceso o por mucho tiempo.
Hoy en día, el uso de mercurio en la medicina ha disminuido mucho, especialmente en países desarrollados. Los termómetros y aparatos para medir la presión arterial con mercurio están siendo reemplazados por opciones electrónicas o sin mercurio.
Producción de Cloro y Sosa Cáustica
El cloro se produce a partir de la sal común (cloruro de sodio) usando electrólisis. En el pasado, se usaba mucho mercurio en este proceso, lo que causaba emisiones de mercurio al ambiente. Sin embargo, las plantas modernas han cambiado a tecnologías más seguras que no usan mercurio.
Uso en Equipos de Laboratorio
El mercurio se usa en algunos termómetros de alta precisión y en telescopios de espejo líquido. También es parte de un tipo de electrodo de referencia en electroquímica. El punto de congelación del mercurio, -38.8344 °C, se usa como un estándar para medir temperaturas.
Iluminación y Electrónica
El vapor de mercurio se usa en lámparas de vapor de mercurio y lámparas fluorescentes. Estas lámparas emiten luz que se usa en espectroscopia para calibrar instrumentos. El mercurio también se encuentra en algunos tubos electrónicos especiales.
-
El brillo de color violeta oscuro de una descarga de vapor de mercurio en una lámpara germicida, cuyo espectro es rico en radiación ultravioleta invisible.
Cosméticos
El mercurio, en forma de tiomersal, se ha usado en la fabricación de rímel. Algunos lugares han prohibido el mercurio en cosméticos debido a preocupaciones de salud.
Armas de Fuego
Un compuesto de mercurio llamado "fulminato de mercurio" se usaba en las cápsulas fulminantes para encender la pólvora en los cartuchos de armas de fuego.
Otros Usos Históricos
El mercurio se ha usado de muchas maneras a lo largo de la historia:
- En tumbas antiguas de la civilización maya, se encontraron cantidades de mercurio líquido, posiblemente para espejos usados en rituales.
- Se usó como colorante en el bermellón, un pigmento rojo brillante.
- En la España Islámica, se usó para llenar piscinas decorativas.
- En los faros antiguos, las lentes de Fresnel flotaban sobre un baño de mercurio para girar suavemente.
- Se usó en Esfigmomanómetros (para medir la presión arterial), barómetros y otros instrumentos de laboratorio.
- Como conductor de electricidad, se usó en interruptores de mercurio y termostatos.
- En las primeras computadoras, se usó como medio en dispositivos de memoria de línea de retardo.
- Se experimentó con turbinas de vapor de mercurio para generar electricidad, pero no tuvieron éxito.
- Se usó como refrigerante en algunos reactores nucleares.
- Las batería de mercurios fueron comunes, pero se prohibieron por la contaminación.
- Se usó para conservar madera, en daguerrotipos (fotografía antigua), para platear espejos y en pinturas para barcos.
- En la minería de oro y plata, el mercurio se usaba para separar el oro de otros materiales.
¿Es Peligroso el Mercurio?
Sí, el mercurio y la mayoría de sus compuestos son muy peligrosos y deben manejarse con mucho cuidado. Si hay un derrame de mercurio (por ejemplo, si se rompe un termómetro), hay que seguir procedimientos especiales de limpieza. No se deben usar aspiradoras ni escobas, ya que pueden dispersar más el mercurio. Se recomienda usar azufre o zinc en polvo para que se mezclen con el mercurio y sea más fácil recogerlo.
El mercurio puede entrar al cuerpo a través de la piel, las mucosas o al respirar sus vapores. Calentar mercurio o sus compuestos puede liberar vapores peligrosos. Las formas más dañinas de mercurio son sus compuestos orgánicos, como el metilmercurio. El mercurio puede causar problemas de salud graves, tanto a corto como a largo plazo.
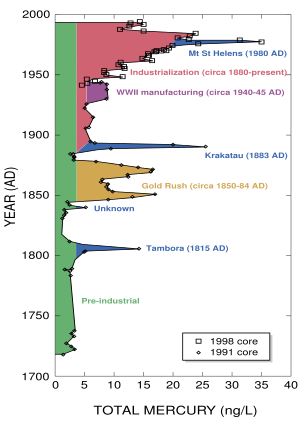
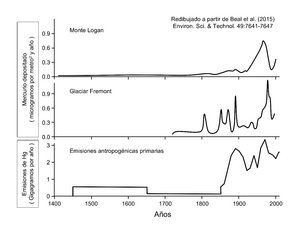
El mercurio también puede llegar al medio ambiente por causas naturales, como los volcanes, y por actividades humanas, como la quema de carbón en centrales térmicas o la minería.
Mercurio en Peces y Mariscos
Los pescados y mariscos pueden acumular mercurio en sus cuerpos, especialmente el metilmercurio, que es muy dañino. Los peces que están en la parte superior de la cadena alimentaria, como tiburones, peces espada y atunes, suelen tener mayores concentraciones de mercurio.
Esto se debe a un proceso llamado biomagnificación: cuando un pez pequeño con mercurio es comido por un pez más grande, el mercurio se acumula en el depredador. Como los peces no eliminan el mercurio fácilmente, sus niveles aumentan con el tiempo. Por eso, se recomienda limitar el consumo de ciertos tipos de pescado. Un ejemplo famoso de este problema es la enfermedad de Minamata en Japón, causada por la contaminación por mercurio.
Precauciones con el Mercurio
Transporte y Almacenamiento
El mercurio se transporta en estado líquido en contenedores bien cerrados, hechos de materiales como acero o vidrio. Se deben evitar contenedores de plomo o aluminio.
Debe guardarse en lugares frescos, secos y bien ventilados, lejos del sol y del calor. A más de 40 °C, el mercurio produce vapores peligrosos.
Manchas de Mercurio
El mercurio puede manchar metales como el oro. Si una joya de oro se mancha con mercurio, se puede calentar suavemente para que el mercurio se evapore y luego pulirla.
Regulaciones sobre el Mercurio
A Nivel Internacional
Un total de 140 países firmaron el Convenio de Minamata sobre el Mercurio en 2013 para evitar emisiones peligrosas de mercurio.
En la Unión Europea
La Unión Europea ha prohibido el mercurio en ciertos productos eléctricos y electrónicos, y ha limitado su cantidad en otros. También ha prohibido el mercurio en termómetros y barómetros no eléctricos desde 2007.
En Otros Países
Países como Noruega, Suecia y Dinamarca han implementado prohibiciones estrictas sobre el uso y la importación de productos con mercurio. En Estados Unidos, la EPA regula la contaminación por mercurio. Se han implementado leyes para reducir el mercurio en pilas y controlar sus emisiones de centrales eléctricas.
Galería de imágenes
-
Cristales de cinabrio con su característico color rojo oscuro, minas de Almadén, Ciudad Real, España.
-
Mercurio nativo con cinabrio, mina Socrates, Sonoma County, California. El cinabrio en ocasiones se altera a mercurio nativo en las zonas de oxidación de los depósitos.
Véase también
 En inglés: Mercury (element) Facts for Kids
En inglés: Mercury (element) Facts for Kids