Helio para niños
Datos para niños Hidrógeno ← Helio → Litio |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Tubo de descarga lleno de helio
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Helio, He, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Gases nobles | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 18, 1, s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 4.0026 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | 1s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
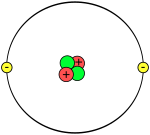
| Electrones por nivel | 2 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Incoloro. Exhibe un brillo gris y turbio (o naranja rojizo si se utiliza un voltaje especialmente alto) cuando se coloca en un campo eléctrico. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | Sin datos (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 31 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 32 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de van der Waals | 140 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 0 (desconocido) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 2372.3 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 5250.5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Gas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 0.1785 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 0,95 K (−272 °C) (a 2,5 MPa) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 4,22 K (−269 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 0.0845 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 5.23 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | hexagonal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 5193 J/(kg·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | Sin datos S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 0.152 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 970 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del helio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El helio (símbolo He) es un elemento químico con el número atómico 2. Su nombre viene del griego antiguo hḗlios, que significa 'Sol'. Esto se debe a que fue descubierto por primera vez en la atmósfera solar en 1868.
El helio es un gas noble, lo que significa que es muy poco reactivo. Es incoloro, inodoro y el elemento con el punto de ebullición más bajo de todos. Solo puede convertirse en líquido bajo presiones muy altas y no se puede congelar a la presión normal de la atmósfera.
En 1868, durante un eclipse solar, el astrónomo francés Pierre Janssen vio una línea amarilla en la luz del Sol que nadie conocía. Otro astrónomo, Norman Lockyer, también la observó y sugirió que era un nuevo elemento, al que llamó helio.
En 1903, se encontraron grandes cantidades de helio en yacimientos de gas natural en los Estados Unidos. Hoy en día, este país es el mayor productor de helio del mundo.
El helio se usa mucho en criogenia (para enfriar cosas a temperaturas muy bajas), especialmente para los imanes de las máquinas de imagen por resonancia magnética. También se usa para proteger en la soldadura por arco y en la fabricación de cristales de silicio. Otros usos conocidos son para inflar globos y dirigibles, y en mezclas de gases para el buceo a gran profundidad.
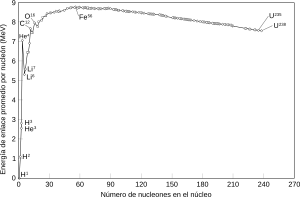
El helio es el segundo elemento más ligero y el segundo más abundante en el universo. Constituye el 24% de la masa de los elementos en nuestra galaxia, la Vía Láctea. La mayor parte del helio en el universo es del isótopo helio-4 (4He), que se cree que se formó poco después del Big Bang.
En la atmósfera de la Tierra, hay muy poco helio. El helio que encontramos aquí se forma principalmente por la desintegración radiactiva de elementos como el torio y el uranio en las rocas. Este helio queda atrapado junto al gas natural, de donde se extrae para su uso comercial.
Contenido
¿Qué hace al helio tan especial?
El helio es un elemento químico con número atómico 2. Aunque tiene una configuración electrónica que podría sugerir otra cosa, se encuentra en el grupo 18 de la tabla periódica de los elementos. Este grupo es el de los gases nobles.
Propiedades únicas del helio
El helio es especial por sus propiedades químicas únicas. Al tener su capa de electrones completa, es muy estable y casi no reacciona con otros elementos. Por eso, es un gas noble.
En condiciones normales de presión y temperatura, el helio es un gas que no se quema y es muy ligero. Es muy difícil convertirlo en líquido porque necesita temperaturas extremadamente bajas, de solo 5.20 K (unos -267.96 °C). Por encima de esta temperatura, no importa cuánta presión se le aplique, el helio no se volverá líquido.
El helio tiene un calor específico muy alto. Esto significa que se calienta y se expande muy rápido. A temperaturas muy bajas, el helio líquido puede volverse un superfluido. Esto es un estado especial donde fluye sin ninguna resistencia, como si no tuviera viscosidad.
El helio tiene el punto de solidificación más bajo de todos los elementos. A presiones normales, incluso en el cero absoluto (0 K o -273.15 °C), el helio-4 sigue siendo líquido. Esto se debe a un efecto de la Mecánica cuántica llamado energía del punto cero. Sin embargo, si se le aplica mucha presión (más de 25 atm), el helio sí puede volverse sólido.
El átomo de helio y la mecánica cuántica
El átomo de helio es el segundo más simple de entender con las reglas de la mecánica cuántica, después del hidrógeno. Tiene dos electrones girando alrededor de un núcleo con dos protones y uno o dos neutrones, según el isótopo.
La estabilidad del núcleo del helio-4 es muy importante. Su núcleo es como una partícula alfa. Esta estabilidad hace que el helio sea el elemento menos reactivo de la tabla periódica. También explica por qué tiene los puntos de fusión y ebullición más bajos.
Esta gran estabilidad del helio-4 es clave en el estudio del universo. En los primeros minutos después del Big Bang, casi todos los nucleones (protones y neutrones) se unieron para formar núcleos de helio-4. Esto dejó muy pocos neutrones libres para crear otros elementos más pesados como el litio, berilio o boro.
Por eso, la mayoría de los elementos más pesados, incluyendo los que forman planetas rocosos como la Tierra y la vida, se crearon después en las estrellas. El helio-4 forma cerca del 23% de toda la materia bariónica del universo, es decir, casi toda la materia que no es hidrógeno.
Fases del helio: gas, plasma, líquido y sólido
El helio es un gas noble muy poco reactivo. En estado gaseoso, su conductividad térmica, calor específico y velocidad del sonido son muy altas. También es el gas menos soluble en agua.
En el espacio, la mayor parte del helio está en estado de plasma. En este estado, los electrones no están unidos al núcleo, lo que hace que el helio sea un buen conductor de electricidad. Las partículas de plasma son afectadas por los campos magnéticos y eléctricos, como se ve en el viento solar y las auroras.
Helio líquido: Helio I y Helio II
A diferencia de otros elementos, el helio líquido se mantiene líquido hasta el cero absoluto a presiones normales. Esto se debe a la energía del punto cero de la mecánica cuántica, que impide que se congele. Para que el helio se vuelva sólido, necesita temperaturas muy bajas (entre 1 y 1.5 K) y mucha presión (alrededor de 25 bar).
- Helio I: Por debajo de su punto de ebullición (4.22 K) y por encima de 2.1768 K, el helio-4 es un líquido normal e incoloro.
- Helio II: Por debajo de 2.1768 K, el helio líquido se convierte en helio II, un superfluido. Este estado tiene propiedades muy extrañas. Por ejemplo, no hierve y tiene una conductividad térmica altísima, un millón de veces mayor que el helio I. El calor se mueve a través del helio II en forma de ondas, un fenómeno llamado "segundo sonido".
El helio II también puede "trepar" por las superficies, incluso contra la gravedad. Forma una capa muy delgada (unos 30 nm) que se mueve por las paredes de los recipientes hasta que encuentra un lugar más cálido y se evapora. Esta capa se llama película de Rollin.
Compuestos de helio
Como el helio es un gas noble, normalmente no forma compuestos químicos. Sin embargo, bajo ciertas condiciones especiales, como descargas eléctricas o bombardeo de electrones, puede formar compuestos inestables llamados excímeros con otros elementos como el wolframio, yodo, flúor y fósforo.
También se ha logrado introducir helio dentro de fullerenos, que son moléculas de carbono con forma de jaula. Aunque el helio no se une químicamente, permanece atrapado dentro. Si se usa helio-3, se puede estudiar fácilmente con espectroscopia de resonancia magnética nuclear.
Isótopos del helio
El helio tiene ocho isótopos conocidos, pero solo el 3He y el 4He son estables. El 4He es el más común y se produce en la Tierra por la desintegración alfa de elementos radiactivos. También se formó en grandes cantidades durante el Big Bang.
El 3He es mucho menos común en la Tierra, pero es más abundante en las estrellas. Se encuentra en pequeñas cantidades en el polvo cósmico y en la superficie de la Luna. Algunas personas han sugerido extraer 3He de la Luna para usarlo en fusión nuclear.
Las mezclas de helio-3 y helio-4 a temperaturas muy bajas se separan en dos fases diferentes. Esto se usa en los refrigeradores de dilución para alcanzar temperaturas extremadamente cercanas al cero absoluto.
Existen otros isótopos de helio que son inestables y se descomponen rápidamente. Por ejemplo, el 5He dura solo una fracción de segundo.
¿Dónde se encuentra y cómo se obtiene el helio?
Abundancia natural del helio
El helio es el segundo elemento más abundante en el universo, después del hidrógeno. La mayor parte se formó en los primeros minutos después del Big Bang. En las estrellas, el helio se produce por la fusión nuclear del hidrógeno.
En la atmósfera terrestre, la cantidad de helio es muy baja (solo 5.2 partes por millón). Esto se debe a que, al ser tan ligero, el helio se escapa al espacio.
Casi todo el helio que hay en la Tierra proviene de la desintegración radiactiva de elementos como el uranio y el torio en las rocas. Este helio se acumula en yacimientos de gas natural, de donde se extrae para su uso comercial. En 2016, se descubrió un gran yacimiento de helio en Tanzania, África, el más grande conocido hasta ahora.
Extracción y producción de helio
Para obtener helio a gran escala, se extrae del gas natural mediante un proceso llamado destilación fraccionada. Como el helio tiene el punto de ebullición más bajo, se enfría el gas natural a temperaturas muy bajas y se le aplica alta presión. Así, los otros gases se vuelven líquidos y el helio se separa. Luego, se purifica para obtener helio de alta pureza.
La mayor parte del helio producido se convierte en líquido para facilitar su transporte, ya que el helio líquido ocupa mucho menos espacio que el gaseoso.
En 2008, la mayor parte del helio mundial provenía de los Estados Unidos, Argelia y Catar. Las reservas de helio son limitadas y se están usando rápidamente. Por eso, es importante reciclar el helio y buscar nuevas formas de extraerlo.
Usos y aplicaciones del helio
El helio es muy útil por sus propiedades únicas, como su bajo punto de ebullición, baja densidad, baja solubilidad y alta conductividad térmica.
- Globos y dirigibles: Como es más ligero que el aire y no se quema (a diferencia del hidrógeno), se usa para inflar globos y dirigibles para publicidad, investigación o incluso para cohetes.
- Buceo profundo: Las mezclas de helio y oxígeno se usan para el buceo a gran profundidad. El helio es menos soluble en la sangre que el nitrógeno, lo que ayuda a los buzos a evitar problemas de presión.
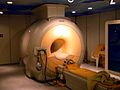
- Refrigeración: Se usa como refrigerante en aplicaciones de muy baja temperatura, como en los imanes superconductores de las máquinas de imagen por resonancia magnética (RMI) en hospitales. El Gran Colisionador de Hadrones del CERN usa helio líquido para mantener sus imanes a temperaturas cercanas al cero absoluto.
- Industria: Se emplea como gas protector en la soldadura por arco y en la fabricación de cristales de silicio y germanio. También se usa para presurizar combustibles líquidos en cohetes.
- Detección de fugas: El helio se difunde muy rápido, por lo que se usa para encontrar fugas en equipos de alto vacío y recipientes a alta presión en la industria.
- Investigación científica: Se usa en reactores nucleares como medio para transferir calor. También es un gas portador común en la cromatografía de gases.
- Láseres: Es un componente de los láseres de helio-neón, que se usan en lectores de código de barras.
- Voz: Inhalar una pequeña cantidad de helio cambia el timbre de la voz, haciéndola más aguda. Esto ocurre porque el helio es menos denso que el aire y las ondas de sonido viajan más rápido a través de él. Sin embargo, inhalar helio directamente de un cilindro puede ser peligroso por el riesgo de asfixia.
Historia del helio
Descubrimiento y estudio
La primera vez que se vio una señal de helio fue el 18 de agosto de 1868. El astrónomo francés Pierre Janssen observó una línea amarilla brillante en el espectro de la luz del Sol durante un eclipse solar en la India. Al principio, se pensó que era sodio.
El 20 de octubre de ese mismo año, el astrónomo inglés Joseph Norman Lockyer también vio la misma línea y propuso que era un nuevo elemento, al que llamó helium, en honor a Helios, el dios griego del sol.
En 1882, el físico italiano Luigi Palmieri encontró helio en la Tierra por primera vez, al analizar la lava del monte Vesubio.
El 26 de marzo de 1895, Sir William Ramsay logró aislar helio en un laboratorio. Lo hizo tratando un mineral llamado cleveíta con ácidos. Otros químicos, Per Teodor Cleve y Abraham Langlet, también lo aislaron ese mismo año en Suecia.
En 1907, Ernest Rutherford y Thomas Royds demostraron que las partículas alfa son en realidad núcleos de helio.
En 1908, el físico neerlandés Heike Kamerlingh Onnes fue el primero en producir helio líquido, enfriando el gas a 0.9 K. Por este logro, ganó el premio Nobel. Su alumno, Willem Hendrik Keesom, logró solidificar el helio por primera vez en 1926.
En 1938, el físico ruso Pyotr Leonidovich Kapitsa descubrió que el helio-4 casi no tiene viscosidad a temperaturas muy bajas, un fenómeno llamado superfluidez. En 1972, se observó el mismo fenómeno en el helio-3, pero a temperaturas aún más cercanas al cero absoluto.
Extracción y uso a gran escala
En 1903, en Dexter, Kansas, se descubrió que un géiser de gas que no se quemaba contenía un 1.84% de helio. Esto demostró que había grandes reservas de helio bajo las Grandes Llanuras de Estados Unidos.
Durante la Primera Guerra Mundial, la Marina de los Estados Unidos apoyó la producción de helio para inflar globos de defensa, ya que el helio no es inflamable. La demanda de helio aumentó durante la Segunda Guerra Mundial para aeronaves y soldadura por arco.
El gobierno de los Estados Unidos creó la Reserva Nacional de helio en 1925 en Amarillo, Texas. Esta reserva se amplió en la década de 1950 para la carrera espacial y la Guerra Fría, ya que el helio líquido era necesario para los cohetes.
Durante muchos años, Estados Unidos produjo más del 90% del helio comercial del mundo. Sin embargo, en la década de 1990, nuevas plantas de extracción en Argelia y Catar comenzaron a producir helio, y Argelia se convirtió rápidamente en el segundo mayor productor.
Precauciones al usar helio
El helio es un gas seguro en condiciones normales. No es tóxico y no tiene un papel biológico en el cuerpo humano. Sin embargo, si se inhala demasiado helio y reemplaza el oxígeno en los pulmones, puede causar asfixia.
Inhalar helio directamente de cilindros a presión es muy peligroso. El gas sale a gran velocidad y puede dañar los tejidos de los pulmones. Aunque es raro, ha habido casos de accidentes graves por inhalación incorrecta de helio.
Cuando el helio se usa para criogenia (a temperaturas muy bajas), se deben tomar precauciones similares a las del nitrógeno líquido. Su temperatura extremadamente baja puede causar quemaduras por congelación. Además, si el helio líquido se calienta y se convierte en gas, se expande mucho, lo que puede causar explosiones si no hay sistemas para liberar la presión.
Galería de imágenes
-
Hoy en día se utiliza helio líquido para refrigerar los imanes superconductores en los escáneres de resonancia magnética.
Véase también
 En inglés: Helium Facts for Kids
En inglés: Helium Facts for Kids