Nitrógeno para niños
El nitrógeno es un elemento químico con el número atómico 7 y el símbolo N. Su masa atómica es de aproximadamente 14,007 unidades. En condiciones normales, el nitrógeno forma un gas que no tiene color ni olor, llamado dinitrógeno o nitrógeno molecular (N2). Este gas es muy importante porque forma alrededor del 78% del aire que respiramos en la atmósfera terrestre.
El nitrógeno es el elemento más ligero del grupo 15 de la tabla periódica, también conocido como el grupo de los pnictógenos. Es uno de los elementos más comunes en el universo, ocupando el séptimo lugar en abundancia en nuestra galaxia, la Vía Láctea, y en el Sistema Solar.
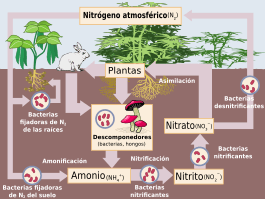
Este elemento es fundamental para la vida. Se encuentra en todos los seres vivos, siendo una parte clave de los aminoácidos (que forman las proteínas), los ácidos nucleicos (ADN y ARN), y la molécula que almacena energía en nuestras células, el trifosfato de adenosina. El cuerpo humano, por ejemplo, está compuesto por aproximadamente un 3% de nitrógeno en masa, lo que lo convierte en el cuarto elemento más abundante en nosotros, después del oxígeno, el carbono y el hidrógeno. El ciclo del nitrógeno describe cómo este elemento se mueve desde el aire, pasa a los seres vivos y a los compuestos orgánicos, y luego regresa a la atmósfera.
El nitrógeno es parte de muchos compuestos importantes para la industria, como el amoniaco y el ácido nítrico. El nitrógeno elemental (N≡N) tiene un enlace muy fuerte entre sus dos átomos. Esta característica hace que sea difícil para los seres vivos y la industria transformar el N2 en otros compuestos útiles. Sin embargo, también significa que cuando los compuestos de nitrógeno se queman o se descomponen para formar gas nitrógeno, liberan mucha energía. El amoniaco y los nitratos que se producen de forma artificial son fertilizantes esenciales para la agricultura.
Además de su uso en fertilizantes, el nitrógeno se encuentra en materiales como el Kevlar, que se usa en telas muy resistentes, y el cianoacrilato, conocido como "superpegamento". También es un componente de muchas medicinas importantes, incluyendo los antibióticos.
Contenido
Historia del Nitrógeno

Los compuestos que contienen nitrógeno se conocen desde hace mucho tiempo. Por ejemplo, el cloruro de amonio ya era conocido en la antigüedad. En la Edad Media, los alquimistas llamaban al ácido nítrico "aqua fortis" (agua fuerte) y a la mezcla de ácido nítrico y ácido clorhídrico la conocían como "aqua regia" (agua real), famosa por su capacidad de disolver el oro.
El descubrimiento del nitrógeno como elemento se atribuye al médico escocés Daniel Rutherford en 1772. Él lo llamó "aire nocivo" porque no permitía la combustión ni la vida. Otros científicos como Carl Wilhelm Scheele, Henry Cavendish y Joseph Priestley también lo estudiaron en la misma época. El químico francés Antoine Lavoisier lo llamó "azote", que viene de una palabra griega que significa "sin vida", porque los animales no podían vivir en una atmósfera de nitrógeno puro y las llamas se apagaban. Aunque este nombre no se usa en inglés, sí se utiliza en muchos otros idiomas.
La palabra "nitrogen" en inglés (y "nitrógeno" en español) viene del francés "nitrogène", creada en 1790 por el químico francés Jean-Antoine Chaptal. Él la formó de la palabra "nitre" (que significa nitrato de potasio o salitre) y el sufijo "-gène", que significa "producir". Chaptal quería decir que el nitrógeno es una parte esencial del ácido nítrico, que se obtenía del nitrato de potasio.
Las primeras aplicaciones importantes de los compuestos de nitrógeno fueron militares y agrícolas. El salitre (nitrato de sodio o nitrato de potasio) se usaba en la pólvora y luego como fertilizante. Durante mucho tiempo, conseguir compuestos de nitrógeno era difícil. Las fuentes naturales eran limitadas. Sin embargo, a principios del siglo XX, se desarrollaron procesos industriales como el proceso Haber-Bosch (1908-1913) que permitieron producir grandes cantidades de compuestos de nitrógeno. Gracias a esto, hoy en día, la mitad de la producción mundial de alimentos depende de los fertilizantes nitrogenados artificiales.
Propiedades del Nitrógeno
Propiedades Atómicas
Un átomo de nitrógeno tiene siete electrónes. Cinco de estos electrones son de valencia, lo que significa que son los que participan en las uniones con otros átomos. El nitrógeno es uno de los elementos con mayor electronegatividad, lo que significa que atrae fuertemente los electrones cuando se une a otros átomos. Solo el cloro, el oxígeno y el flúor son más electronegativos. Su tamaño es más pequeño que el del boro y el carbono, pero más grande que el del oxígeno y el flúor.
Isótopos del Nitrógeno
El nitrógeno tiene dos isótopos estables: el nitrógeno-14 (14N) y el nitrógeno-15 (15N). El 14N es mucho más común, representando el 99,634% del nitrógeno que encontramos en la naturaleza. El 15N es un poco más pesado y constituye el 0,366% restante. Ambos isótopos estables se forman en las estrellas.
La cantidad de 14N y 15N es casi siempre la misma en la atmósfera. Sin embargo, puede variar en otros lugares, como en el suelo, debido a procesos biológicos. Por ejemplo, las reacciones que ocurren en el suelo, como la nitrificación y la desnitrificación, pueden cambiar la proporción de estos isótopos.
El isótopo más pesado, 15N, fue descubierto en 1929. Se utiliza en estudios científicos para entender las estructuras de moléculas que contienen nitrógeno.
Usos del Nitrógeno
El uso más importante del nitrógeno en la industria es para producir amoniaco mediante el proceso de Haber. El amoniaco se usa después para fabricar fertilizantes y ácido nítrico.
Las sales del ácido nítrico son compuestos importantes. Por ejemplo, el nitrato de potasio (también llamado salitre) se usaba en la fabricación de pólvora. El nitrato de amonio es un fertilizante muy común.
Algunos compuestos orgánicos de nitrógeno, como la nitroglicerina, son explosivos. La hidracina y sus derivados se usan como combustible en cohetes.
El nitrógeno es un gas poco reactivo. Por eso, se usa en la industria para crear atmósferas protectoras, por ejemplo, para evitar que los alimentos se echen a perder o que ciertos materiales reaccionen con el oxígeno. También se usa como gas criogénico (que produce temperaturas muy bajas) para obtener temperaturas de alrededor de -196 °C de forma sencilla y económica. Incluso se utiliza para inflar los neumáticos de los trenes de aterrizaje de los aviones, lo que ayuda a evitar la condensación de agua a grandes alturas o que se incendien al aterrizar.
El nitrógeno está presente en la atmósfera no solo como N2, sino también en otros compuestos como los óxidos de nitrógeno (NOx), que incluyen el N2O, el NO y el NO2. Estos óxidos son producto de procesos de combustión y contribuyen a la contaminación del aire.
Abundancia y Obtención
El nitrógeno es el componente principal de la atmósfera de la Tierra, constituyendo el 78,1% de su volumen. Para usos industriales, se obtiene mediante la destilación del aire líquido. También se encuentra en los restos de animales, como el guano, en forma de urea y ácido úrico.
El nitrógeno también forma parte del 3% de la composición elemental del cuerpo humano.
Se han encontrado compuestos que contienen nitrógeno en el espacio exterior, y el isótopo Nitrógeno-14 se forma en los procesos de fusión nuclear que ocurren en las estrellas.
La mayor parte del nitrógeno que se usa en la industria química se obtiene separándolo del aire líquido. Luego, este nitrógeno se usa para fabricar amoniaco, a partir del cual se producen muchos otros productos químicos.
Compuestos de Nitrógeno
El nitrógeno forma muchos compuestos importantes:
- Con el hidrógeno forma el amoniaco (NH3), la hidracina (N2H4) y el aziduro de hidrógeno (N3H). El amoniaco líquido puede actuar como una base o un ácido en diferentes situaciones.
- Con los halógenos (como el flúor, cloro, bromo y yodo) forma compuestos como el NF3 y el NCl3.
- Con el oxígeno forma varios óxidos, como el óxido nitroso (conocido como "gas de la risa"), el óxido nítrico y el dióxido de nitrógeno. Estos óxidos son producidos por la combustión y contribuyen a la contaminación del aire. Otros óxidos, como el trióxido de dinitrógeno (N2O3) y el pentóxido de dinitrógeno (N2O5), son muy inestables.
Importancia Biológica del Nitrógeno
El nitrógeno es un componente esencial de los aminoácidos y los ácidos nucleicos, que son vitales para todos los seres vivos. Es el nutriente mineral que más influye en el crecimiento de las plantas y, por lo tanto, en la productividad primaria de los ecosistemas. Esto afecta a todos los organismos que dependen de las plantas. El gran aumento en la producción de cosechas desde que se empezaron a usar fertilizantes nitrogenados en el siglo XIX lo demuestra.
A pesar de que hay mucho nitrógeno en la atmósfera, la mayoría de los organismos no pueden usarlo directamente en su forma gaseosa (N2). Las plantas solo pueden absorberlo eficientemente en forma de iones amonio (NH4+) o nitrato (NO3-).
Algunas plantas tienen una relación especial con bacterias y hongos que sí pueden transformar el nitrógeno del aire en amonio. A cambio, la planta les da energía. Un ejemplo muy conocido son las bacterias del género Rhizobium que viven en las raíces de las leguminosas. Estas bacterias "fijan" el nitrógeno, incorporándolo a la cadena trófica.
Precauciones con el Nitrógeno
Los fertilizantes nitrogenados pueden ser una fuente importante de contaminación del suelo y del agua. Algunos compuestos que contienen iones de cianuro son extremadamente tóxicos y pueden ser mortales para muchos animales, incluyendo los mamíferos. El amoniaco también es muy tóxico.
Efectos del Nitrógeno en la Salud
Las moléculas de nitrógeno se encuentran principalmente en el aire. En el agua y en los suelos, el nitrógeno se encuentra en compuestos como nitratos y nitritos.
Los seres humanos hemos alterado las proporciones naturales de nitratos y nitritos, principalmente por el uso de fertilizantes. Las industrias también liberan grandes cantidades de nitrógeno. Con el tiempo, ha aumentado la concentración de nitratos y nitritos en el suelo y el agua, lo que se refleja en un aumento de nitrógeno en las fuentes de agua potable.
Los nitratos y nitritos pueden tener varios efectos en la salud humana:
- Pueden reaccionar con la hemoglobina en la sangre, disminuyendo su capacidad para transportar oxígeno. (Esto ocurre con los nitritos).
- Pueden afectar el funcionamiento de la glándula tiroidea. (Esto ocurre con los nitratos).
- Pueden reducir el almacenamiento de vitamina A. (Esto ocurre con los nitratos).
- Pueden favorecer la producción de nitrosaminas, que se asocian con el riesgo de cáncer. (Esto ocurre con nitratos y nitritos).
Desde el punto de vista del cuerpo, el óxido nítrico (NO) es muy importante. En 1987, Salvador Moncada descubrió que el óxido nítrico es un mensajero vital en el cuerpo para la relajación de los músculos. Hoy se sabe que está involucrado en el sistema cardiovascular, el sistema inmunitario y los sistemas nerviosos.
Véase también
 En inglés: Nitrogen Facts for Kids
En inglés: Nitrogen Facts for Kids
- Ciclo del nitrógeno
- Dinitrógeno
- Nitrógeno líquido
- Hidroxilamina